실패한 것으로 알려졌던 아두카누맙 임상시험이 새로운 분석 결과를 통해 알츠하이머병에 임상적 유의성을 확인한 것으로 나타났다.
이에 따라 공동 개발사인 바이오젠과 에자이는 아두카누맙을 알츠하이머병 신약으로 허가를 추진할 계획이다.
22일(현지시간) 바이오젠과 에자이는 미국FDA와 논의를 통해 이 같은 결정을 했다고 발표했다.
회사 측은 지난 3월 무용성 평가를 통해 아두카누맙 개발 프로그램을 중단하기로 결정했었다.
하지만 임상 3상 시험에서 나온 추가적인 데이터가 포함된 광범위한 데이터세트를 분석한 결과를 바탕으로 아두카누맙 프로그램을 부활시키기로 했다.
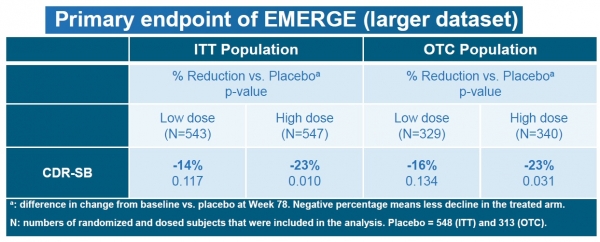
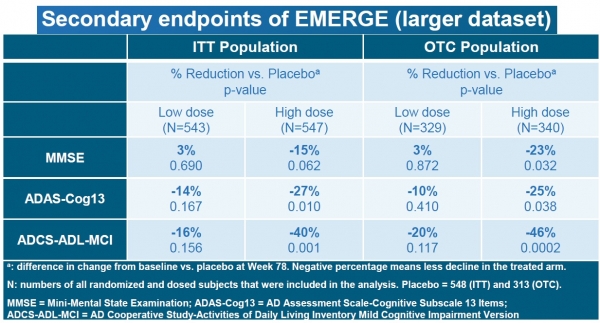
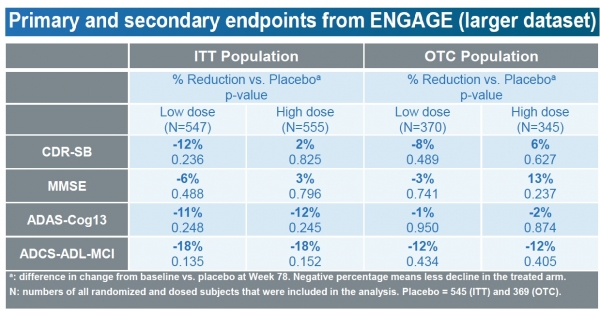
임상 3상 EMERGE 연구에 대한 추가 데이터 분석 결과, 임상적 저하 감소에 대한 1차 평가변수가 충족됐으며, ENGAGE 임상 3상에서 고용량 아두카누맙을 복용한 일부 환자들의 결과가 인지저하를 유의미하게 늦춰졌다고 회사 측은 분석했다.
아두카누맙을 투여받은 환자들은 기억, 지남력, 언어능력 같은 인지 및 기능 평가지표에서 유의한 혜택을 경험했으며, 일상생활 활동에 대한 혜택도 경험했다는 설명이다.
회사 측은 이 같은 결과를 바탕으로 내년 FDA에 신약 허가신청을 할 계획이며, 유럽이나 일본 등에 대해서도 신약 승인을 추진한다.
하지만 일부 연구자들은 임상 3상에 대한 연구 결과 공개가 일부에 불과해 추가적인 검토가 필요하다는 입장을 보이고 있다.
바이오젠 원문 자료 링크 https://investors.biogen.com/static-files/5a31a1e3-4fbb-4165-921a-f0ccb1d64b65