
뇌내 '미세아교세포(microglia)'의 활성을 조정하는 차세대 유전자 편집 기술이 대표적 난치성 질환으로 꼽히는 치매 치료 분야에도 적극 활용될 전망이다.
중추신경계의 면역기능을 담당하는 미세아교세포는 뇌에서 신경퇴행 반응을 일으키는 다양한 독성물질들을 제거하고 신경 뉴런(neuron)을 보호하는 데 핵심적인 역할을 맡고 있다. 최신 분석 결과, 이러한 미세아교세포의 상태 변화를 조절하는 유전자 기술이 알츠하이머병 치료에도 성공 가능성을 시사한 것으로 확인됐다.
주인공은 '크리스퍼(CRISPR·유전자가위)' 기술이다. 해당 유전자 편집 기술을 통해 미세아교세포의 기능을 정상화시키는 방안을 골자로 한다. 이를 놓고 학계 전문가들은 "노인성 치매를 유발하는 알츠하이머병 치료에 획기적인 전환점이 마련될 것"이란 기대감을 내놓고 있다.
미국 샌프란시스코 캘리포니아대학(UCSF) 신경퇴행질환연구소 Martin Kampmann 교수팀이 진행한 크리스퍼 유전자 편집 기술 평가 논문은 국제학술지 'Nature Neuroscience' 2022년 8월 11일자 온라인판에 게재됐다.
핵심은 이렇게 정리된다. 미세아교세포의 상태 변화가 알츠하이머병 등과 같은 퇴행성 뇌신경질환의 잠재적인 동인으로 작용할 수 있다는 의견을 직접적으로 언급한 것이다.
책임저자인 Kampmann 교수는 논문을 통해 "건강한 미세아교세포는 중추신경계에 쌓인 노폐물과 독성물질을 제거해 뉴런이 최상의 기능을 수행하도록 돕는 일을 한다"며 "만약 미세아교세포의 기능에 이상이 생겨 정상적인 임무를 하지 못한다면 신경계에 염증이 생기고 뉴런과 신경망이 심각한 수준으로 손상을 입게 된다"고 강조했다.
이 같은 발견을 위해 연구팀은 인간 유도만능줄기세포(induced pluripotent stem cells, iPSCs)에서 분화한 미세아교세포를 평가에 이용했으며, 이를 스크리닝하기 위한 전략으로 크리스퍼 유전자 편집 플랫폼도 별도로 개발했다. 여기서 관건은, 미세아교세포의 상태가 변화할 때 특정 유전자들의 개입 여부와 상태가 조절되는 양상을 파악하는 것이었다.
그 결과, 미세아교세포의 상태 변화에 따라 관여하는 핵심 유전적 조절인자들에는 차이가 있으며 결국 약물에 의한 표적치료가 가능하다는 사실을 확인했다는 대목이다.
연구팀은 "미세아교세포의 개별 유전자를 조정할 수 있는 크리스퍼 기술을 사용해 어떤 유전자가 미세아교세포의 생존과 대량 증식에 영향을 주는지 확인할 수 있었다"며 "유전자가 오작동한 미세아교세포의 경우엔 염증성 물질들을 활발히 생성하고 시냅스(신경세포 접합부)를 망가뜨리는 것으로 관찰됐다"고 설명했다.
따라서 "크리스퍼 플랫폼 신기술을 활용해 미세아교세포의 활동을 조절할 수 있는 방안을 고려해야 할 시점"이라며 "미세아교세포의 일탈 행동 중 하나인 독성물질의 과다생성을 중단시키고, 본연의 임무인 청소작업을 원활히 수행할 수 있도록 다시 제어할 수 있을 것"이라고 밝혔다. 이는 신경퇴행 질환 치료에 있어 완전히 새로운 유형의 치료적 기회를 제공한다는 점을 거듭 피력했다.
Kampmann 교수는 "크리스퍼 기술은 세포의 메커니즘을 밝히는 과정에서 특정 유전자의 발현을 끄거나 켤 수 있기에 이미 의학 연구 분야에서도 널리 사용되고 있다"며 "다만 미세아교세포 자체는 대체로 크리스퍼 기술에 잘 반응하지 않으며, 연구자가 원하는 유전물질을 바이러스에 실어 전달하는 것 조차도 저항반응을 보인다는 제한점은 있다"고 소개했다.
성숙한 미세아교세포의 경우, 크리스퍼 도구를 전달하는데 사용되는 '렌티바이러스(lentivirus)'에도 저항성을 나타내기 때문에 기존의 크러스퍼 유전자 프로파일링 작업은 어려움이 많았다는 부분이다.
◆유전자 조절자? CD209·PFN1 발현 주목…"CSF1R 억제제 등 기존 약제 활용 임상 예정"
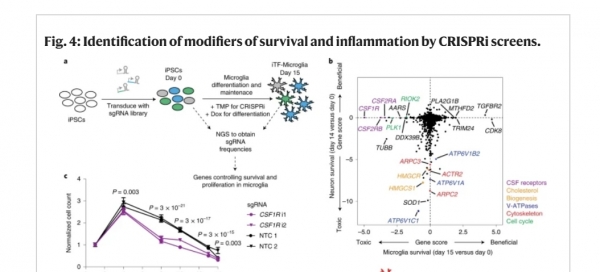
연구팀은 이러한 난제를 극복하기 위해 새로운 크리스퍼 플랫폼 기술을 개발하면서 연구에 차별화를 꾀했다. 세부 연구를 살펴보면 먼저 미세아교세포와 유사한 세포를 생성할 수 있는 인간 유도만능줄기세포를 이용했으며, 이들 세포는 여섯 가지 특정 전사인자(transcription factor)를 발현할 수 있도록 설계됐다.
다음 작업으로 크리스퍼 기술을 사용해 약물 투여가 가능한 게놈(genome) 라이브러리를 조작했다. 해당 게놈은 단백질 인산화효소(protein kinase) 및 기타 약물 투여가 가능한 단백질을 인코딩하는 2,325개의 유전자로 구성됐다.
분석 결과는 어땠을까. 미세아교세포와 신경세포의 생존에 영향을 미치는 유전자가 상당히 다르다는 사실이 포착됐다. 이를테면 '집락자극인자(colony stimulating factor, CSF)' 수용체에 속하는 'CSF1R'의 발현을 줄이는 것은 신경세포가 아닌 미세아교세포의 생존을 유의하게 감소시켰다. 여기서 CSF1R은 미세아교세포 생존에 관여하는 유전자 조절자로 확인된 것이다.
연구팀은 "일반적으로 뇌를 청소하는 미세아교세포는 알츠하이머병의 특징인 베타 아밀로이드반을 포함한 죽은 신경 뉴런과 원치 않는 단백질을 쓸어낸다"며 "하지만 미세아교세포가 과민반응을 보일 경우 염증을 일으키고 신경세포의 사멸이나 신경전달의 핵심인 시냅스의 상실로 이어져 신경퇴행을 악화시킬 수 있다"고 언급했다.
이 밖에도 미세아교세포의 염증 활성화 반응에 관여하는 조절인자도 추가로 확인됐다. '미토콘드리아복합체-I(mitochondrial Complex-I)'의 조직 구성을 줄이는 것은, 대식세포(macrophage)에서 미세아교세포의 염증반응을 촉진시키는 것으로 나타난 것이다.
더불어 뉴런 시냅스의 조절과 관련해, 'CD209' 단백질의 과발현은 미세아교세포의 활성을 크게 증가시키는 것으로 관찰됐으며, 미세아교세포에서 'PFN1'의 발현이 증가함에 따라 면역 관련 유전자와 알츠하이머 위험 유전자의 발현 변화가 확인됐다.
연구팀은 "알츠하이머병 및 다발성경화증, 뇌종양 등의 마우스(실험용 쥐) 모델에서 질병과 관련된 'SPP1'이 높게 발현된 경우, 다이이치 산쿄(Daiichi Sankyo)가 개발한 CSF1R 억제제 'PLX3397'을 투여하자 문제가 발생한 미세아교세포 집단을 크게 줄일 수 있는 것으로 분석됐다"고 설명했다.
이에 연구팀은 기존 약물을 활용해 망가진 미세아교세포를 고칠 수 있는 표적치료 연구를 병행한다는 입장을 견지했다. 이미 개발된 약물을 대상으로, 특정 유전자에 작용하는 물질을 발굴해 내는 것이 연구의 주요 취지로 잡혔다.
Kampmann 교수는 "새로운 플랫폼 기술을 기반으로 미세아교세포의 상태를 조절하는 표적치료 전략을 연구할 계획"이라며 "미세아교세포를 건강한 상태로 되돌리기 위해 관련 유전자들이나 단백질에 작용할 수 있는 약물을 찾는 것이 우선 목표"라고 전했다.
<논문> Dräger, N.M., Sattler, S.M., Huang, C.TL. et al. A CRISPRi/a platform in human iPSC-derived microglia uncovers regulators of disease states. Nat Neurosci 25, 1149–1162 (2022). https://doi.org/10.1038/s41593-022-01131-4.


