포스텍(포항공과대) 연구팀이 알츠하이머와 파킨슨이 함께 일어나도록 하는 원인 물질의 구조를 규명했다.
포스텍 화학과 박준원 교수·통합과정 신은지 씨 연구팀이 원자 힘 현미경을 이용해 헤테로-올리고머의 표면 구조를 조사해 알츠하이머 질환과 파킨슨 질환의 중첩에서 발견되는 헤테로-올리고머의 정체를 밝혔다.
이번 연구는 세계적인 학술지 ‘나노 레터스(Nano Letters)’ 최신호 표지논문으로 게재됐다.
알츠하이머병과 파킨슨병의 중첩은 아밀로이드-베타 및 알파-시누클레인에서 파생된 헤테로-올리고머 형성과 관련이 있다는 사실은 알려져 있었다. 그러나 헤테로-올리고머의 구조를 보기에는 기술적 한계가 있어 치료법을 연구하기 어려웠다.
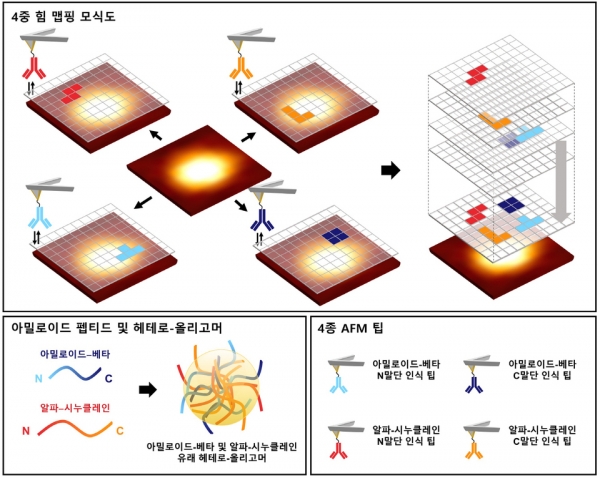
연구팀은 원자 힘 현미경(AFM)을 이용해 나노미터(nm) 해상도로 알츠하이머 질환의 바이오마커로 알려진 아밀로이드-베타와 파킨슨 질환의 바이오마커로 알려진 알파-시누클레인으로부터 유래한 헤테로-올리고머 응집체의 표면 특성을 단일 분자 수준에서 관찰했다.
연구팀이 각 펩타이드의 N-말단 또는 C-말단을 인식하는 항체가 고정된 4개의 AFM 팁으로 조사한 결과, 모든 응집체는 헤테로-올리고머인 것을 확인했다. 또 헤테로-올리고머의 경우 펩타이드 말단을 인식할 확률이 호모-올리고머보다 더 높다는 것을 확인했다.
이 결과는 호모-올리고머보다 헤테로-올리고머에서 각 펩타이드의 말단이 표면에 위치하는 경향이 더 크거나, 표면에 위치한 펩타이드 말단들이 더 많은 자유도를 가지고 있음을 알려준다.
즉, 호모-올리고머보다 헤테로-올리고머에서 펩타이드 간 응집이 더 느슨하게 이루어지는 것을 확인할 수 있다.
이 연구는 4종의 AFM 팁을 이용해 그동안 밝혀지지 않았던 단백질 응집체의 구조를 나노미터 단위 수준에서 4중으로 관찰한 첫 연구로, ‘헤테로-올리고머 응집’ 가설을 규명할 실험적 근거가 된다.
알츠하이머나 파킨슨 이외에도 다른 퇴행성 뇌신경 질환 중첩에 관련된 연구에도 활용될 수 있다.
포스텍 박준원교수는 “지금까지는 나노 크기의 단백질 응집체에 대하여 분석할 수 있는 적절한 방법이 존재하지 않아 이종 응집체의 정체를 밝히는 것이 불가능했다”며 “이 연구에서 개발된 분석 방법은 다른 아밀로이드성 단백질 응집체 연구에 적용할 수 있어 알츠하이머 질환이나 광우병 같은 병의 원인을 밝히는 데 도움이 될 것”이라고 의의를 밝혔다.
<논문> Shin EJ, Park JW. Nanoaggregates Derived from Amyloid-beta and Alpha-synuclein Characterized by Sequential Quadruple Force Mapping. Nano Lett. 2021 May 12;21(9):3789-3797. doi: 10.1021/acs.nanolett.1c00058.


