식약처, 허가·심사 가이드라인 발간...상용화에 속도
앱이나 가상현실, 소프트웨어 등으로 질환을 치료할 수 있는 디지털치료기기 허가를 받기 위해서는 해당 제품에 대한 임상시험 자료를 반드시 체출해야 한다.
또 허가 이후에도 모니터링을 위해 실사용증거 자료 제출이 요구될 수 있어 개발업체들이 숙지해야 한다.
27일 식약처는 디지털치료기기 정의, 판단 기준 등을 주요 내용으로 하는 '디지털치료기기 허가·심사 가이드라인'을 발간했다.
식약처는 디지털치료기기(Digital Therapeutics, DTx)를 치료 작용기전에 대한 과학적·임상적 근거를 바탕으로 질병의 예방‧관리‧치료를 목적으로 사용하는 소프트웨어 의료기기로 정의했다.
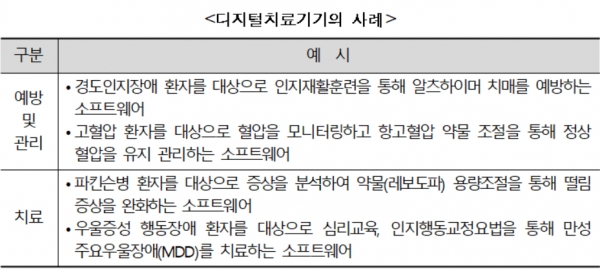
디지털치료기기는 약물중독이나 우울증 등 정신·신경계 질환뿐 아니라 천식, 당뇨 등 다양한 질환의 치료에 적용될 수 있다. 전임상 단계가 없어 기존 신약 개발에 비해 비용이나 시간이 적게 소요된다.
실제 신약의 평균 비용은 평균 3조원인 데 반해 디지털치료기기는 100~200억원 정도가 소요된다. 또 개발기간도 신약은 15년, 디지털치료기기는 3.5~5년 정도로 짧다.
이미 여러 국내·외 업체들이 디지털치료기기 개발에 뛰어든 상태며, 이번 가이드라인 제공에 따라 국내에서도 상용화에 속도를 붙일 수 있게 됐다.
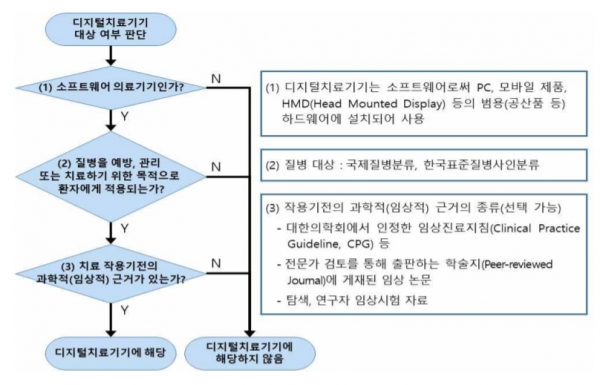
식약처가 공개한 가이드라인에 따르면, 허가를 위한 제출자료는 크게 '기술문서'와 '성능 및 유효성 검증 자료'로 나뉜다.
제출해야 하는 '기술문서'에는 작용원리, 사용목적, 성능, 시험규격 등을 포함해야 한다. '성능 및 유효성 검증자료'에는 작용원리에 관한 자료, 성능에 관한 자료, 임상시험에 관한 자료의 요건 및 제출범위 제시 등이 포함된다.
특히 디지털치료기기의 안전성·유효성 입증을 위해 해당 제품에 대해 전향적 임상시험(Prospective Clinical Study) 자료를 제출해야 한다.
다만, 해당 제품이 개발 단계에 있고 치료 기전에 대한 임상적 근거의 유무에 따라 확증 임상시험 전에 탐색 임상시험이 필요할 수도 있다.
탐색 임상시험이 치료 기전의 근거를 생성하기 위한 목적이라면 임상시험계획승인 시 제출되는 ‘작용원리에 관한 자료’는 유사제품에 대한 논문이나 문헌 등을 발췌해 제출이 가능하다.
결과적으로 디지털치료기기에 대한 확증 임상시험을 수행하기 위해서는 치료 기전에 대한 임상적 근거인 임상논문이나 임상 진료지침, 또는 탐색 임상시험 등의 자료가 반드시 필요한 셈이다.
이와 함께 식약처는 디지털치료기기는 허가 이후에도 잠재적 유익성과 위해성을 모니터링하기 위한 목적으로 실제 임상환경에서의 실사용 데이터(Real World Data)를 수집·활용한 실사용증거(Real World Evidence) 자료를 요구할 수 있다.
식약처는 "가이드라인 발간을 통해 디지털치료기기를 연구하는 의료기기 업체의 제품 개발에 도움이 될 것"이라고 밝혔다.

