초저온 전자현미경 단층촬영 통해 Aβ·타우 단백질 분자 구조 확인
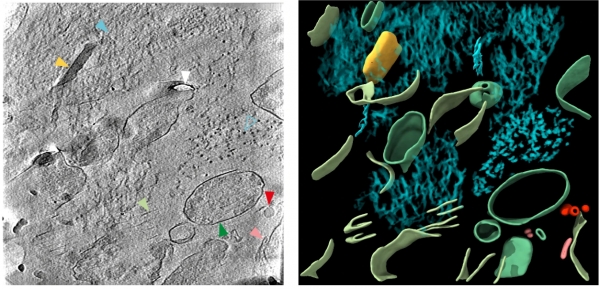
영국 리즈대(University of Leeds) 연구팀은 초저온 전자현미경 단층촬영(Cryo-ET) 등 기술을 통해 사후 알츠하이머병 환자 뇌에서 원인 물질인 아밀로이드 베타(Aβ)와 타우(Tau) 단백질의 조직 내 분자 구조를 확인했다.
이번 연구 성과는 지난 10일 국제 학술지 ‘네이처(Nature)’에 실렸다.
연구팀에 따르면, 대부분 신경퇴행성 질환의 병리학적 특징은 단백질이 아밀로이드로 조립돼 질병 특화 구조를 형성한다는 점이다.
알츠하이머병은 응집성이 매우 강한 아밀로이드 베타와 타우의 침착이 원인인 것으로 알려졌다. 아밀로이드 베타는 뇌세포 외부에 끈적끈적한 플라크(plaque)를 형성하는 반면에 타우는 세포 내부에 비정상적인 필라멘트를 생성한다.
이에 따라 아밀로이드 베타 플라크와 비정상적 타우 필라멘트가 세포 간 통신을 막아 뇌세포가 죽는 현상을 보인다.
연구팀이 초저온 전자현미경으로 고해상도 촬영을 한 결과, 아밀로이드 베타 플라크에서는 일부 가지를 이루는 원섬유(fibrils)와 프로토필라멘트(protofilaments)가 병렬 배열과 격자 구조로 혼합된 모습을 확인했다.
아밀로이드 베타 플라크의 비아밀로이드 성분에서는 세포외 소포와 직육면체 입자가 보였다. 이 같은 모습은 치매에 걸리지 않은 사람의 사후 조직 단층촬영에서는 발견되지 않았다.
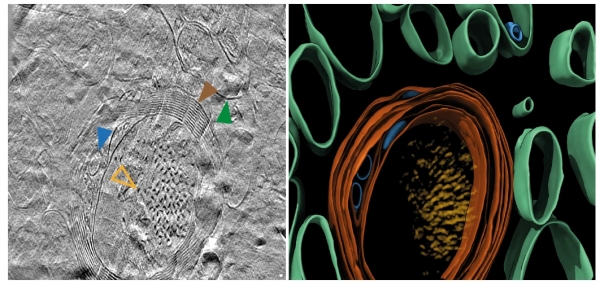
타우는 가지가 없는 필라멘트가 평행한 군집으로 배열돼 있었다. 타우 군집은 세포 안팎에서 관찰됐다.
또 136개의 타우 필라멘트로 이뤄진 군집에서 평균화한 하위 단층촬영을 통해서는 조직 내에서 쌍을 이룬 나선형 필라멘트의 폴리펩타이드 백본이 접힌 형태와 필라멘트 극성 방향을 밝혀냈다. 대부분 군집 내의 필라멘트는 서로 유사했으나 군집 간에는 다른 것으로 나타났다.
연구팀은 “이번 연구로 밝혀진 조직 내 구조 워크플로우를 다양한 뇌 영역과 초기 단계의 알츠하이머병 기증자로 구성된 대규모 코호트에 적용하면 다양한 구조의 아밀로이드 공간 조직이 각각의 신경병리학적 프로파일과 어떻게 관련되는지 밝혀낼 수 있다”고 강조했다.
Primary Source
Gilbert, M.A.G., Fatima, N., Jenkins, J. et al. CryoET of β-amyloid and tau within postmortem Alzheimer’s disease brain. Nature (2024). https://doi.org/10.1038/s41586-024-07680-x

