임상시험 승인 11건 중 5건 임상 1상...초기 개발·연구 활발
지난해 식품의약품안전처가 승인한 치매약 관련 임상은 11건이었으며, 초기 임상에 집중된 것으로 나타났다.
26일 식약처의 2017년 임상시험계획 승인 현황을 분석한 결과, 전체 승인 건수는 658건으로 전년 628건 대비 4.8% 증가했다고 밝혔다.
효능군별로는 항암제(251건), 심혈관계(61건), 중추신경계(54건), 내분비계(45건), 소화기계(41건) 순으로 많았다.
이 중 항암제에서는 특정 표적만 선택적으로 공격하는 표적항암제가 114건(45.4%)으로 가장 많았고 면역항암제 89건(35.5%)으로 뒤를 이었다.
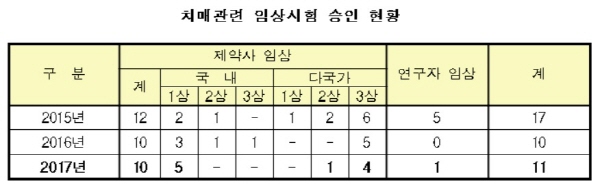
치매 치료제 임상시험에서 임상 1상이 차지하는 비중은 2016년에는 10건 중 3건에서 지난해에는 11건 중 5건으로 초기 개발·연구가 활발했다.
제약사가 의약품 개발, 허가 등을 목적으로 시행한 임상시험 승인 건수는 476건으로 4.2% 증가했다.
제약사 임상시험 중에서는 국내외에서 실시하는 다국가 임상이 293건 승인돼 9.7% 증가했다. 다국가 임상시험 중에서도 3상 승인이 2016년 136건에서 지난해 178건으로 30.9% 늘었다.
연구자가 학술 목적으로 허가받은 의약품 등을 활용해 새로운 적응증, 용법·용량 등을 탐색하는 연구자 임상시험은 182건 승인돼 6.2% 증가했다.
전체 임상시험 승인 건수에서 합성의약품 422건(64.1%), 바이오의약품 213건(32.4%), 생약(한약)제제 23건(3.5%) 순이었다.
디멘시아뉴스 최봉영 기자(bychoi@dementianews.co.kr)

