알자멘드 뉴로 개발, ALZN002 백신 최초 임상시험 돌입 계획 공표

알츠하이머병 치매 관리를 위한 차세대 '면역치료 백신' 개발에 가속도가 붙을 전망이다.
바이오테크 알자멘드 뉴로(Alzamend Neuro)가 개발 중인 알츠하이머병 치매 백신 후보물질 'ALZN002(실험물질명)'가 임상평가를 위한 본격 절차를 밟기 시작했다.
환자 본인의 수지상세포(dendritic cell)를 활용해 특수한 항원을 접종하는 능동면역(active immunization) 치료전략으로 개발에 귀추가 주목된다.
업계에 따르면, 최근 알자멘드 뉴로는 ALZN002 백신의 안전성과 적정 투약용량 설정을 위한 임상 신약신청(IND)을 미국식품의약국(FDA)에 제출한 것으로 나타났다. 경증에서 중등도 치매 환자를 타깃으로 잡은 해당 백신의 유효성 조사를 위해 1/2a상임상 연구에 돌입한다는 계획을 공표한 것.
회사는 성명서를 통해 "이번 IND 제출은 독점 백신 파이프라인 개발을 위한 중요한 이정표가 될 것"이라며 "알츠하이머병의 진행을 늦추고 신경퇴행 및 인지저하를 예방 또는 지연시키는 새로운 치료전략으로 기대가 크다"고 밝혔다.
이어 "FDA의 임상허가 타임라인에 맞춰 면역치료 백신의 개발단계에 대한 자세한 정보를 제공할 수 있을 것"으로 전했다.
◆백신 'ALZN002' "강력한 면역반응 지속될 것"…"환자 세포 이용 안전성 합격점"
해당 백신 후보물질은 돌연변이 팹타이드 감작세포를 활용하는 세포 기반 백신 치료제로, 면역체계를 자극해 알츠하이머 환자의 뇌에서 베타 아밀로이드반의 축적을 억제하도록 설계됐다.
무엇보다 치료 환자의 자가면역세포를 이용한다는 점이 차별점으로 꼽힌다. 채집된 환자의 수지상세포를 실험실에서 수정한 뒤, 환자에 다시 주입해 베타 아밀로이드 단백 응집체에 대한 면역반응을 유도하도록 하는 것이다.
여기서 수지상세포는 면역계의 항원제시세포(APC)로, 면역반응을 유발하는 항원물질을 처리하고 이를 세포 표면에 발현시켜 면역 T세포에게 제시하는 주요 기능을 담당한다.
선천성 면역계와 적응성 면역계를 연결해 주는 전달자로서의 역할을 가지는 셈이다. 수지상세포가 활성화되면 체내 림프절로 이동해 T세포 및 B세포와의 상호작용을 통해 적응성 면역반응을 시작하는 것으로 알려졌다.
ALZN002 백신은 이러한 메커니즘을 기반으로 개발됐다. 실험실적으로 만들어진 베타 아밀로이드 단백의 작은 조각을 수지상세포에 발현시키고, 해당 단백질에 대한 항체 생성을 촉발시켜 뇌에서 독성 응집체의 형성을 제거하게 되는 것. 이를 통한 치매 관련 증상의 개선혜택을 기대하는 것으로 풀이된다.
회사는 "면역반응을 유발하기 위해 특수한 항원을 접종하는 해당 능동면역 치료전략은 강력하고 장기간 지속되는 효과를 제공할 것으로 기대된다"며 "환자 본인의 세포를 사용함으로써 거부감 없이 보다 안전하게 사용할 수 있을 것으로도 예상된다"고 설명했다.
일단 알츠하이머병 마우스(실험용 쥐) 모델을 대상으로 한 비임상 결과, ALZN002 백신의 치료적 이점이 보고됐다. 90일 동안 ALZN002를 총 5회 접종받은 마우스 모델에서는 마지막 백신 접종 90일 후 어떠한 부작용 발생 없이 베타 아밀로이드반의 축적을 유의하게 감소시킨 것으로 나타났다.
또한 조직 분석 결과, 뇌에 T세포의 침윤이나 뇌와 척수와 관련해 심각한 뇌수막염(meningoencephalitis) 징후는 관찰되지 않았다. 결국 백신 접종에 따른 안전성과 내약성 측면에는 합격점을 받은 것이다. 실제로 치료와 관련된 사망 사례는 보고되지 않았으며 추적관찰 기간 신체 및 장기 무게, 조직 분석 등에서도 변화가 포착되지 않았다.
미국FDA 임상 허가 결정에 따라 진행될 이번 연구는, 인간을 대상으로 한 최초의 임상시험으로 알츠하이머병으로 인한 경증 내지 중등도 치매 환자 20~30명에서 위약 대비 ALZN002의 다중상승용량(multiple ascending dose, 이하 MAD) 평가를 통해 백신의 안전성 및 내약성, 유효성을 저울질하게 된다.
더불어 후속 2b상임상인 'ALZN002-02 연구'는 백신의 최적 용량을 결정하는 데 핵심자료가 될 예정. 알자멘드 뉴로는 첫 임상시험 결과 분석 후 3개월 이내에 ALZN002-02 연구를 시작할 것으로 계획잡고 있다.
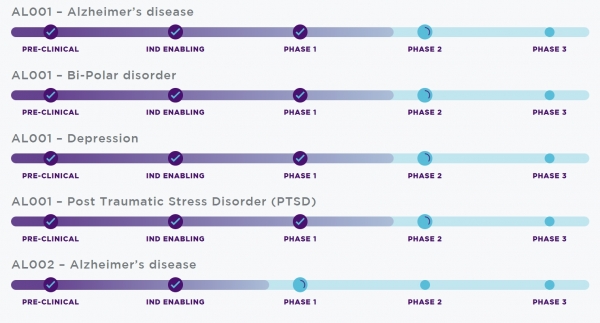
◆약물 독성 부담 줄인 리튬 신약 후보 'AL001' 2상 돌입…"연말 톱라인 결과 발표 예정"
한편 알자멘드 뉴로는 올해 5월 급성 조증 및 양극성장애(조울증) 치료에 널리 사용되는 탄산리튬(lithium carbonate)을 개량한 복합제 후보물질 'AL001(실험물질명, 제품명 리프로살 LiProSal)'의 본격 2상임상 평가에도 착수한 상황이다.
해당 신약 후보물질의 경우 알츠하이머병을 비롯한 양극성장애, 우울증, 외상후 스트레스장애(PTSD) 등에까지 치료 적응증 범위를 폭넓게 잡고 있다.
본 2a상임상(NCT05363293)인 다중용량상승평가(MAD)는 미국 조지아주 애틀랜타에 위치한 단일 임상기관을 시작으로 평가가 시행된다. 연구에는 50세~80세 연령의 경도에서 중등도 알츠하이머병 환자 40명이 모집될 계획이다.
AL001의 최대내약용량(maximum tolerated dose) 설정 및 안전성과 내약성 평가가 해당 임상의 주요 과제로 설정됐다. 따라서 임상참가자들에는 14일 동안 1일 3회 AL001 또는 위약을 증량해 무작위 투약하고 치료 후 42일간 추적관찰이 진행된다.
앞서 회사는 기업 컨퍼런스콜을 통해 관련 임상의 주요 톱라인 분석 결과는 오는 12월경 발표할 예정으로 전했다.
알자멘드 뉴로는 "리튬은 35년 넘게 처방되면서 이미 안전성 프로파일을 확립했기 때문에 신약 후보물질인 AL001의 경우도 시판허가와 관련한 규제 및 개발일정을 단축시킬 수 있을 것"이라고 내다봤다.

