'TfR1' 활용 BBB 투과 플랫폼 ‘브레인셔틀’ 적용 Aβ 표적 항체 치료제
78세 女, 뇌출혈로 연구 44일 차에 숨져...CAA 소견, 향후 연구 제외
"ARIA-E, 3건으로 매우 제한적"...주입 관련 이상 반응 발생률도 줄어

로슈(Roche)가 지난 30일(현지 시간) 알츠하이머병 임상시험(Clinical Trials on Alzheimer's Disease, CTAD) 국제 콘퍼런스에서 자사가 개발 중인 알츠하이머병 치료제 트론티네맙(Trontinemab)의 임상 1b/2a상 중간 결과를 발표하면서 뇌출혈로 숨진 환자가 발생했다고 밝혔다.
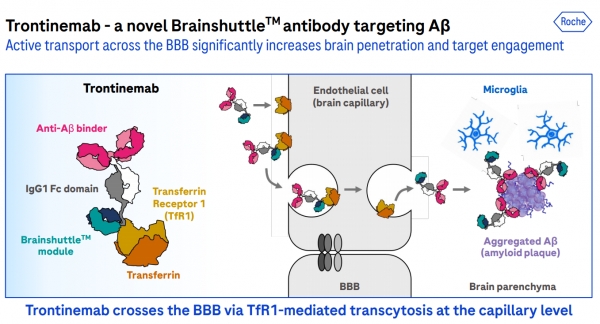
트론티네맙은 로슈의 뇌혈관 장벽(BBB) 투과 플랫폼인 ‘브레인셔틀(Brain Shuttle)’을 적용한 아밀로이드 베타(Aβ) 표적 항체 치료제다. 브레인셔틀은 트랜스페린 수용체 1(Transferrin Receptor 1, TfR1)을 활용해 항체의 BBB 투과율을 극대화하는 플랫폼이다.
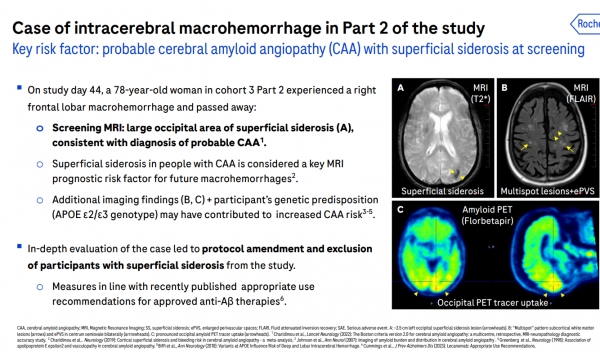
이번 발표 자료에 보고된 뇌출혈(intracerebral macrohemorrhage) 사례에 따르면, 78세인 여성 환자가 우측 전두엽에서 큰 출혈이 발생해 연구 44일 차에 사망했다.
주요 위험 요인으로는 MRI 검사를 통해 ‘표재성 철침착증(superficial siderosis)’을 동반한 뇌 아밀로이드 혈관 병증(CAA)의 가능성이 제기됐다. CAA는 알츠하이머병 환자에게서 흔히 나타나는 병증이다.
로슈는 이번 연구에서 CAA 환자의 표재성 철침착증을 향후 뇌출혈의 MRI 예후 위험인자로 간주했다. 또 추가로 제시된 MRI 및 아밀로이드 PET 영상 소견과 환자의 유전적 소인(APOE ε2/ε3)이 CAA 위험을 더 높였을 수 있다고 분석했다.
이를 심층 평가한 로슈는 임상 프로토콜을 수정해 상당한 위험 요인으로 표재성 철침착증이 있는 참가자를 연구에서 제외하기로 했다.
이번 중간 연구에는 환자 60명을 대상으로 용량이나 위약을 증량하는 코호트 4개가 등록됐다. 아직 완료되지 않은 파트 2에서는 트론티네맙 1.8 mg/kg 또는 위약을 투여받은 환자(코호트 3, 60명), 3.6 mg/kg 또는 위약을 투여받은 환자(코호트 4, 35명)로 나눴다. 사망한 환자의 경우 파트 2의 코호트 3인 1.8 mg/kg 그룹에 속했다.
로슈는 이번 연구에서 트론티네맙에 대해 전반적으로 양호한 안전성 프로파일을 보였고, 항아밀로이드 항체의 주요 부작용인 ARIA-E(Edema, 부종)는 매우 제한적으로 관찰됐다고 밝혔다.
로슈에 따르면, 완료된 브레인셔틀 AD(Brainshuttle AD)의 파트 1 결과에서 12~28주 치료 후 1.8 mg/kg 및 3.6 mg/kg 투여군에서 알츠하이머병의 원인 물질로 추정되는 아밀로이드 플라크(Plaques, 덩어리)가 빠르고 강력하게 줄어든 것으로 확인됐다.
ARIA-E 사례는 지난달 2일 기준으로 파트 1·2에서 단 3건만 발생했다고 보고했다. 주입 관련 이상 반응(IRR) 발생률도 줄어든 것으로 나타났다.
또 예비 파트 1 데이터에 따르면, 아밀로이드가 빠르게 제거될 때 뇌척수액(CSF)의 총 타우, p-tau181 및 뉴로그라닌(Neurogranin)을 포함한 관련 바이오마커에 큰 규모의 변화가 동반됐다고 발표했다.
한편, 세계 알츠하이머병 임상 연구 관련 연례 학술회의인 CTAD는 지난 29일(현지 시간)부터 내달 1일까지 스페인 마드리드와 온라인에서 열린다.

- 애브비, ‘TfR’ 활용 BBB 투과 플랫폼 기업 ‘알리아다’ 인수...2조 규모
- ‘CTAD 2024’ 국제 콘퍼런스, 29일부터 스페인 마드리드서 열려
- [치매 정복 나선 K-바이오텍] ① 아임뉴런 김한주 대표 (上)
- 로슈, 항타우 항체 치료제 ‘베프라네맙’ 개발 포기...UCB에 권리 반환
- [치매 정복 나선 K-바이오텍] ① 아임뉴런 김한주 대표 (下)
- 아임뉴런, 치매극복연구개발사업단과 ‘알츠하이머병 항체 치료제’ 과제 협약
- 에이비엘바이오, 혈뇌장벽 셔틀 이중항체 플랫폼 연구결과 공개
- |CTAD 2022| 간테네루맙 임상 실패, '트론티네맙' 불씨 살릴까
- [ASPAC 2024] ASPAC 2024 개막, ‘3D 증후군의 더 나은 치료법' 조명
- ‘레켐비’ 원개발사 바이오아크틱, 美 BMS와 13.5억佛 규모 항체 치료제 계약 체결
- 국내 연구진 “3D 바이오프린팅으로 뇌혈관 장벽 新모델 개발”
- 인간 뇌에는 ‘한 스푼 분량’ 미세플라스틱 있다
