배진건 박사(이노큐어 테라퓨틱스, 수석부사장)

타우(Tau)는 한 마디로 뇌신경세포(CNS)에 존재하는 단백질이다. 타우는 미세소관(microtubules)과 결합하고 또한 여러 곳에 인산화되는 단백질이다.
이 미세소관은 뇌세포 안에서 화물을 실어 나르는 통로 역할을 하고 세포 분열을 용이하게 하는 실 모양의 작은 구조물이다. 타우 단백질이 응집해 형성되는 '타우 탱글'은 알츠하이머성 치매 등 퇴행성 질환을 일으키는 원인이다.
타우는 특이하게 프롤린(proline)과 라이신(lysine)의 함유량이 많아 20%나 된다. 이런 특이한 함량은 단백질의 유연성을 높이고 병리학적인 crosslinking과 서로 엉키는 Neurofillament Tangle (NFT)이 만들어지도록 도우는 것 같다.
타우의 N-말단(NTR)에 세포막과 결합할 수 있는 부분이 있고 이어 프롤린이 풍부한 proline-rich (PRR) 부분과 microtubule binding region (MTBR)이 존재하고 C-말단(CTR)으로 이어진다[아래 논문 그림].
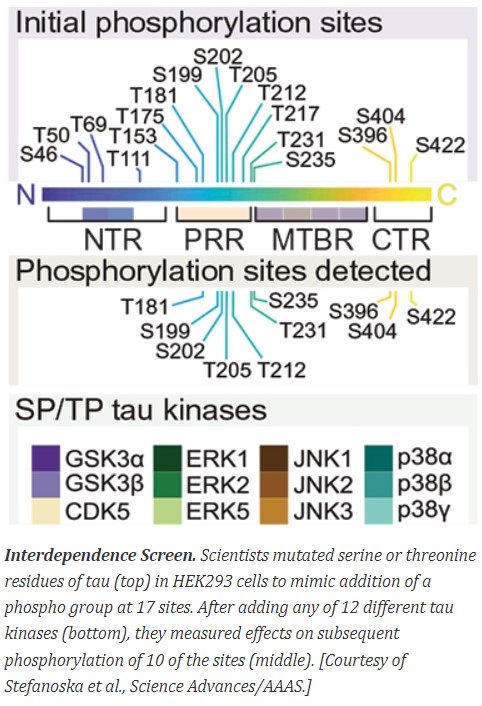
타우 단백질은 어떻게 구성돼 존재하는가? 한개의 타우 유전자가 RNA 수준에서 재조합을 통해 6개의 작은 차이의 다른 단백질이 뇌에서 발현된다. 그중 '2N4R'이라고 이름 지은 가장 큰 단백질이 441 아미노산(amino acids)으로 구성되었다.
수많은 세포 신호전달과정을 조절하는 인산화(phosphorylation)가 무정형 응집체 형성을 촉진하는 결정적 요인임을 짐작할 수 있다. 가장 긴 '타우 isoform'의 아미노산 배열을 읽어보면 통틀어 17개 Ser/Thr 사이트(site)가 인산화되고 연이어 'Pro'이 바로 다음 아미노산으로 존재한다. 이들 인산화 사이트는 타우의 'MTBD'인 245~368번의 아미노산 순서보다 아미노(NH2) 쪽인 ‘PRR’에 대부분 존재하지만 MTBD의 카르복실(COOH)쪽에도 3개가 존재한다.
'Thr-Pro'은 50, 69, 111, 153, 175, 205, 213, 235과 'Ser-Pro'은 46, 199, 202, 396, 405, 422가 존재한다. 타우 단백질의 아미노산 순서를 체크하였을 때 특이하게도 181, 217, 231은 'Thr-Pro-Pro'으로 존재하기에 필자가 놀랐다. 우연의 일치일까? 'Thr'이 인산화되고 연이어 'Pro'이 하나도 아니고 'Pro-Pro'이 계속되면 단백질이 'conformational change', 즉 단백질 구조의 변화가 만들어지는 것이다.
또 하나 연결 가능성은 Pin1이란 이성질화 효소이다. Pin1은 'peptidyl‒prolyl cis/trans isomerase (PPIase)'이다. 타우의 'Thr'이 인산화되면 'Pin1 이성질화 효소'가 작용하여 신경세포 사멸억제 작용을 한다. 이런 이성질화 효소 작용이 암과 알츠하이머에 중요한 역할을 한다고 알려졌다. 'Thr-Pro-Pro'은 눈 여겨 보아야 할 아미노산 시퀀스이다.
타우 인산화의 주범 노릇을 하는 'Master'는 어느 인산화 아미노산일까? 이 질문을 던지고 답을 풀어낸 논문이 'Alzheimer's disease: Ablating single master site abolishes tau hyperphosphorylation'이란 제목으로 출간되었다[Sci Adv. 2022 Jul 8;8(27):eabl8809. Epub 2022 Jul 6 PubMed.] 이전에 발표된 논문들도 'prime sites'가 존재할 것으로 추론하였다. 하지만 이번 논문처럼 조직적(systematic)으로 연구를 진행하지는 않았다.
연구자들은 인간의 타우를 HEK293 신장세포에 발현시키고 GSK3β, CDK5와 ERK, JNK, MAP p38 등 12개의 인산화 단백질인 카이네이즈를 동시에 신장세포에 발현시켰다. 연구자들은 조직적으로 17개의 아미노산을 Ser은 Asp, Thr은 Glu으로 마치 인산화된 형태의 음성기를 가진 아미노산으로 바꾸었다. 그리고 그 치환 결과로 다른 아미노산 사이트에 영향을 미치는지 조사는 이 방대한 실험은 2,000 조합이 만들어지는 조직적(systemic) 실험이었다.
실험 결과는 5개의 T50, T69, T111, T181, T205; Thr 아미노산을 찾아내었다. 이들 '마스터 사이트' 후보자인 T50, T69, T111, T181과 T205은 N-terminal과 PRR에 집중되었다. T181이 가장 영향력을 지닌 'Master' 후보로 도출되었다. 현재 알츠하이머 진단에 사용되는 마커들인 S199, S202, T205와 T231이 다른 비교 실험에 포함되었다. 아쉽게도 다른 유명한 바이오마커인 T217은 'readout'에 포함되지 않았다.
논문 저자들이 'interdependency' 라고 붙인 마스터 사이트는 MAP kinase p38α가 존재할 때 가장 인산화가 강하게 되었다. MAPK p38α가 'Aβ-induced toxicity'를 나타내기에 알츠하이머 타겟으로 잘 알려졌고 현재 'neflamapimod(VX-745)'가 임상 3상을 시작하여 진행 중이다. 그러기에 이번 논문의 저자들은 T181가 타겟팅 사이트(targeting site)라고 기술하고 있다.
한편 스웨덴 고텐부르그대학(University of Gothenburg) 연구팀이 2020년 11월에 발표한 논문이 '마스터 사이트'를 뒷받침한다. 연구팀은 뇌척수액 검사를 통해 알츠하이머병으로 분류된 381명의 검사 결과를 분석했다. 이 중 3분의 1은 아직 인지적 문제는 발생하지 않았고 나머지 3분의 2에는 인지적 문제까지 발생한 상황이었다.
분석 결과 두 집단 중 인지적 문제가 아직 발생하지 않은 집단에서만 인산화 타우단백질 중 T181과 T217이 발견됐다. 연구팀은 "이 두 가지 인산화 타우단백질은 정상인이나 알츠하이머가 상당히 진행된 이들에게는 나타나지 않아 지금보다 몇 년 정도 일찍 알츠하이머병을 감지하는 훌륭한 바이오마커가 될 것"이라고 확신했다.
왜 이 3개의 'Thr-Pro-Pro'을 주목해야 하나? '타우 isoform'이 인산화된 이후 알츠하이머병 환자에게 발견되는 타우 단백질은 254개 아미노산 타우로 잘리어 뇌척수액(CSF)와 혈액으로 방출된다. 이렇게 방출된 주 인산화된 타우가 'p-Tau181', 'p-Tau217', 'p-Tau231'이다.
우리는 뇌척수액으로 배출된 인산화된 단백질의 양을 'biomarker'로 선정해 알츠하이머병 발병과 심각도를 진단하기 때문이다. 다른 잡범들보다 타우 인산화를 촉진시키는 주범(Master)에 주목하면 알츠하이머를 푸는 도구가 빠르게 우리 손에 잡힐 것 같다.

