베이스라인에서 5주 차까지 CMAI 총점 변화 통계적 유의성 확보 실패
액섬 "1상 및 나머지 2상에서는 성공적...하반기 FDA에 NDA 제출할 것"
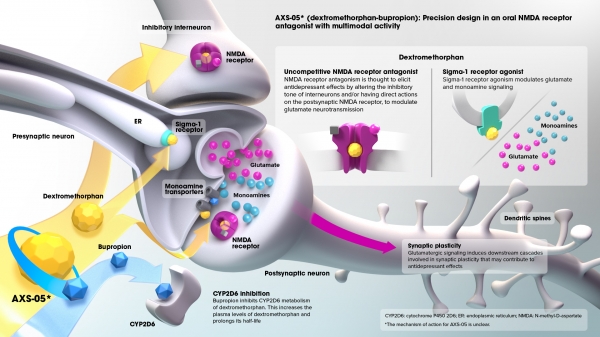
미국 중추신경계(CNS) 질환 치료제 개발 기업 액섬 테라퓨틱스(Axsome Therapeutics, 이하 액섬)는 지난달 30일(현지 시간) 알츠하이머병 환자의 초조증(Agitation) 신약 후보물질인 ‘AXS-05’의 임상 3상 주요 결과를 발표했다.
두 종류로 진행된 임상 3상 중 일부에서는 1차 평가 변수를 통계적으로 유의하게 충족시키지 못한 것으로 나타났다.
액섬이 개발 중인 AXS-05는 ‘덱스트로메토르판(Dextromethorphan)’과 ‘부프로피온(Bupropion)’ 성분의 경구용 NMDA(N-Methyl-D-Aspartate) 수용체 길항제다.
덱스트로메토르판은 신경전달물질인 글루타메이트(Glutamate)의 활동을 조절하고, 부프로피온은 노르에피네프린과 도파민의 재흡수를 억제한다.
액섬은 이번 발표를 통해 임상 3상인 ‘ACCORD-2’ 및 ‘ADVANCE-2’ 시험을 포함한 임상 데이터를 공개했다.
재발 시간을 평가하는 임상 3상 ‘ACCORD-2’에서 1차 평가 변수는 ‘코헨-맨스필드 초조 척도’(Cohen-Mansfield Agitation Inventory, CMAI)‘ 총점의 변화였다. 총 295명의 환자가 최대 12개월 동안 오픈 라벨 치료를 받았다. 베이스라인에서의 CMAI 총점은 73.3점이었다.
그 결과, 치료군에서 위약군보다 초조증의 재발 시간이 통계적으로 유의하게 늦춰진 것으로 확인됐다.(p=0.001) 재발 위험은 위약군에 비해 3.6배 낮은 것으로 나타났다.
치료군에서는 6주 차에 CMAI 총점 베이스라인에서 20.4점 감소하는 평균 감소율을 보였다. 이는 베이스라인 평균 점수 대비 46% 감소한 수치다. 베이스라인 대비 30% 이상 감소한 ’CMAI 임상 반응‘을 보인 환자는 69%에 달했다.
임상의의 ‘수정 알츠하이머병 협력 연구-임상 글로벌 변화 인상(mADCS-CGIC)’으로 평가한 알츠하이머병의 초조증 개선은 치료 후 6주 차에 78%의 환자에서 달성된 것으로 나타났다. 간병인의 ‘환자 전반적 변화 인상(PGI-C)’을 통해 평가한 결과, 치료 후 4주 차에 71%, 8주 차에 78% 개선된 것으로 확인됐다.
또한 최소 8주 동안 치료받은 환자 중 70%가 지속적인 임상 반응을 보였고, 이중맹검 기간에 무작위로 배정됐다. 총 167명의 환자가 무작위로 배정되었고, 83명은 AXS-05를 계속 투여하고 84명은 위약으로 전환했다. 무작위 배정 시 CMAI 총점 평균은 치료군과 위약군에서 각각 44.3점과 45.4점이었다.
주요 2차 평가 변수에서는 알츠하이머병 초조증 상태의 재발이 통계적으로 유의하게 현저히 감소하는 것으로 보고됐다. 알츠하이머병 환자 가운데 8.4%가 재발한 반면, 위약군으로 전환한 환자의 28.6%가 재발한 것으로 확인됐다.(p=0.001)
특히 ’임상 전반 인상-중등도 질환(Clinical Global Impression-Severity Illness, CGI-S)‘ 점수 변화에서 치료군의 20.5%가 악화된 것에 비해 위약으로 전환한 환자의 41.7%가 악화된 것으로 보고됐다.(p=0.004) 또 치료군의 13.3%가 CGI-S에서 알츠하이머병의 전반적인 임상 상태가 악화된 반면, 위약으로 전환한 환자의 39.3%가 악화된 것으로 나타났다.(p<0.001)
다만, 임상 3상 ’ADVANCE-2‘에서는 1차 평가 변수인 베이스라인에서 5주 차까지 CMAI 총점 변화에 대한 통계적 유의성을 입증하지 못한 것으로 보고됐다.(치료군과 위약군의 CMAI 감소 점수 각각 13.8점, 12.6점)
ADVANCE-2는 알츠하이머병 환자 중 초조증을 보이는 환자를 대상으로 AXS-05를 투여하는 이중맹검, 위약 대조, 병렬군 임상시험이었다. 총 408명의 환자가 5주 동안 AXS-05 또는 위약 치료에 1대 1 비율로 무작위로 배정됐다.
하지만 1차 및 다른 2차 평가 변수에서의 결과는 위약군보다 치료군이 더 나은 결과를 보였다고 회사 측은 설명했다.
한편, 이번 연구에서 AXS-05는 낙상, 인지기능 저하나 진정 작용의 위험 증가와 관련이 없는 것으로 나타났다. 피험자 중 사망자도 나오지 않았다.
액섬은 이번 연구 데이터를 바탕으로 올해 하반기 미국 식품의약품청(FDA)에 알츠하이머병 환자의 초조증에 대한 AXS-05의 신약허가신청서(NDA)를 제출할 계획이다.

