‘Paa’, Aβ42 응집 48.7% 억제...신경세포 독성 완화 효과 확인
한국과 미국 공동연구팀이 알츠하이머병 주요 원인으로 알려진 아밀로이드 베타(Aβ42) 단백질의 비정상적 응집을 효과적으로 억제하는 새로운 구조 기반 펩타이드 억제제를 개발했다.
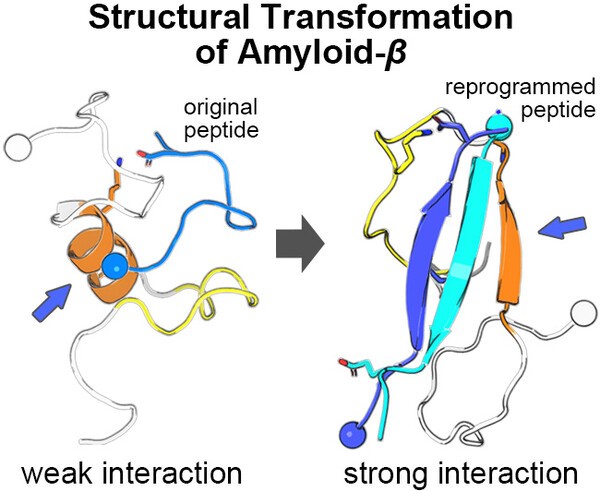
고려대 화학과 김준곤 교수팀과 미국 캘리포니아공과대(caltech) 화학공학과 윌리엄 고다드 3세(William A. Goddard III) 교수팀은 ‘이황화 결합(disulfide bond)’을 활용해 ‘역평행 베타 시트(antiparallel β–sheet)’ 구조를 유도하는 이중 펩타이드 설계로 아밀로이드 베타 응집을 구조적으로 억제하는 데 성공했다고 발표했다.
연구에 따르면, 아밀로이드 베타는 본질적으로 형태를 유연하게 바꾸는 특성이 있는 단백질로, 응집 초기 단계인 올리고머화(oligomerization) 과정에서 베타 시트로 구조적 변화가 빠르게 일어난다. 이에 따라 기존 펩타이드 억제제는 특정 부위를 표적으로 하는 설계가 어렵고, 단일 사슬 구조로 아밀로이드 베타와 결합할 때 불안정성을 보이는 한계가 있었다.
연구팀은 아밀로이드 베타 응집에서 핵심 역할을 하는 부위인 중앙 영역(K16–A21)과 C-말단(G38–A42)을 표적으로 설정하고, ‘REMD(Replica Exchange Molecular Dynamics)’ 시뮬레이션 기법을 활용해 11개 아미노산으로 구성된 펩타이드 ‘Pa11(HOKLVNFAEDV)’을 최적 후보로 선정했다.
이후 Pa11을 이황화 결합으로 ‘이량체화(Paa)’해 역평행 베타 시트 구조로 안정화했다. 이는 아밀로이드 베타의 응집 핵 형성을 방해해 병리적 구조 형성을 억제하는 것으로 나타났다. Paa는 단량체인 Pa11보다 아밀로이드 베타와의 결합력이 약 2배 증가한 것으로 보고됐다.

특히 CD(Circular Dichroism) 분광법 분석에서는 Paa의 농도가 높아질수록 베타 시트 구조가 유의하게 줄어든 모습이 관찰됐다.
실제 세포 실험에서도 ThT 분석(Thioflavin T assay) 결과 아밀로이드 응집 정도가 대조군에 비해 48.7%로 감소했다.
TEM(Transmission Electron Microscope) 이미지를 통해서도 응집체 양이 눈에 띄게 줄어든 것으로 확인됐다. 세포 독성 실험에서는 신경세포 생존율이 70.7%에서 95.8%로 개선됐다. 이는 Paa가 독성 올리고머 형성을 선제적으로 차단했기 때문으로 해석된다.
화학적 특성 측면에서는 Paa는 단량체인 Pa11보다 용해도가 더 높고, 혈장 내 반감기는 훨씬 더 짧았다. 또한 송아지 혈관을 이용한 세포 기반 실험에서는 48시간 후 35%가 세포층을 투과했지만, 인공 뇌혈관 장벽(blood-brain barrier, BBB) 실험에서는 거의 통과하지 못했다.
연구팀은 “Paa의 억제 효과는 단량체인 Pa11뿐만 아니라 기존 LPFFD와 같은 베타 시트 구조 억제제보다 탁월하다”며 “이 전략은 타우(Tau), 알파 시누클레인(α-synuclein), TDP-43, FUS 등 다양한 신경퇴행성 질환 관련 단백질을 표적으로 삼는 분야로 폭넓게 적용될 수 있을 것”이라고 강조했다.
이번 연구 결과는 지난 9일(현지 시간) 독일 화학회가 발행하는 국제 학술지 ‘앙게반테 케미(Angewandte Chemie)’에 온라인으로 실렸다.
Source
D. Im, Ye E. Lee, G. Yoon, W. A. GoddardIII, T. Su Choi, H. I. Kim, Antiparallel β-Sheet as a Key Motif of Amyloid-β Inhibitor Designed via Topological Peptide Reprogramming, Angew. Chem. Int. Ed.. 2025, e202504640. https://doi.org/10.1002/anie.202504640

