극저온 전자현미경으로 Aβ–TTR 결합 모습 확인…세포 실험에서 저분자 펩타이드 효능 입증
부산대학교 연구팀이 알츠하이머병의 핵심 발병 요인인 아밀로이드 베타(Amyloid-β, Aβ) 응집을 억제하는 단백질 복합체의 구조를 규명하고, 이를 기반으로 한 치료 후보물질을 제시했다.
이번 연구는 7월 31일 생화학·약리학 분야의 국제학술지 <Biochemical Pharmacology> 온라인판에 게재됐다.
연구팀은 극저온 전자현미경(Cryo-EM) 분석을 통해 Aβ와 트랜스타이레틴(Transthyretin, TTR)이 결합해 형성하는 복합체의 3차원 구조를 고해상도로 해명했다.
TTR은 혈액과 뇌척수액에 존재하며 Aβ 응집을 막는 보호 단백질로 알려졌지만, 그 작용 원리는 명확히 밝혀지지 않았다. 이번 구조 분석으로 Aβ 결합 부위와 상호작용 네트워크가 구체적으로 드러나면서, 응집 억제의 분자적 메커니즘이 과학적으로 입증됐다.
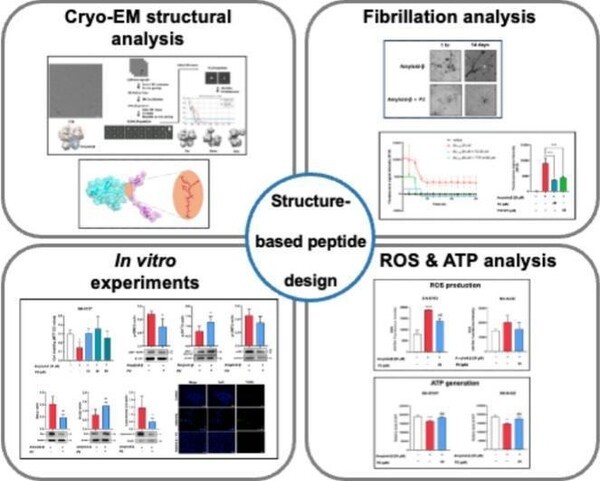
이 구조 정보를 바탕으로 연구팀은 Aβ에 특이하게 결합해 응집을 사전에 역제할 수 있는 TTR 유래 저분자 펩타이드 후보를 설계했다. 해당 펩타이드는 인간 신경모세포종 세포주(SH-SY5Y, SK-N-DZ)에서 Aβ로 인한 독성을 유의하게 감소시켰으며, 세포 생존율을 높이고 활성산소종(ROS, Reactive Oxygen Species 산소가 화학 반응 과정에서 전자를 잃거나 얻어 반응성이 매우 높아진 분자나 이온) 생성 억제와 미토콘드리아 기능 보호 효과를 보였다. 이는 기존 치료제들이 주로 응집 후 제거를 목표로 하는 데 비해, 응집 억제 중심의 접근이 가능함을 보여준다.
현재 승인된 대표적 Aβ 타깃 알츠하이머 치료제인 레카네맙(Lecanemab)은 Aβ 초기 응집체인 ‘프로토피브릴(Protofibril)’을 항체가 인식해 제거하는 방식이다. 그러나 항체 기반 치료제는 정맥주사 투여가 필요하고, 혈액-뇌 장벽(BBB) 투과율이 낮으며, 반복 투여 시 아밀로이드 관련 영상 이상(ARIA) 부작용 가능성이 존재한다.
반면 이번에 제시된 저분자 펩타이드 전략은 구조 분석을 통해 설계 근거가 명확하고, BBB 투과 가능성이 높으며, 경구를 포함한 다양한 투여 경로를 적용할 수 있다는 장점이 있다. 또 항체보다 분자량이 적어 조직 침투력이 높고 면역 부작용 위험이 낮아 향후 임상 단계로 발전할 잠재력이 크다.
이번 연구는 장세복 부산대학교 분자생물학과 교수가 책임저자이자 교신저자로 연구를 총괄했으며, 정미숙 금정제약(주) 대표가 공동 교신저자로 참여했다. 실험과 데이터 분석은 제1저자인 이한나 부산대 생명시스템연구소 전임연구원이 주도적으로 수행했다.
장세복 교수는 “이번 연구는 알츠하이머병의 병인인 Aβ 응집을 억제하는 복합체를 구조적으로 규명하고, 이를 바탕으로 정밀하게 설계된 치료 펩타이드 후보물질을 제시했다는 점에서 기존 치료의 한계를 극복할 수 있는 중요한 기반이 될 것”이라며, “향후 전임상 및 임상으로 이어질 수 있는 구조 기반 신약 개발에 결정적 기여를 할 것으로 기대한다”고 밝혔다.
본 연구는 과학기술정보통신부 및 교육부·한국연구재단 기초연구사업 및 개인기초연구지원사업의 지원으로 수행됐다.
논문
Lee HN, Han CW, Jeong MS, Jang SB. Cryo-EM structure of Amyloid-β and Transthyretin complex and its implications for neuroprotective in neuroblastoma cell lines. Biochem Pharmacol. 2025 Jul 29;242(Pt 3):117201. http://doi.org/10.1016/j.bcp.2025.117201. Epub ahead of print. PMID: 40744232.

