자문기구, ICER 기준 3배 이상 초과...MCID 미충족 지적
에자이 “장기 효과 반영 안 돼...가치 과소평가” 반박
최근 영국서도 비용 효과성 문제로 건강보험 등재 반대
일본 정부가 에자이(Eisai)의 초기 알츠하이머병 치료제인 ‘레켐비(Leqembi, 성분명 레카네맙 Lecanemab)’의 약가를 낮추는 방안에 대한 검토에 나섰다.
일본 후생노동성 산하 자문기구는 레켐비의 효과 대비 비용이 과도하다는 평가 결과를 토대로 약가 인하 필요성에 무게를 싣고 있다. 이에 에자이는 정부의 평가가 레켐비의 임상 가치를 충분히 반영하지 못했다며 강하게 반발하고 있다.
후생성 중앙사회보험의료협의회(중의협)는 지난 9일 총회를 열고, 레켐비의 비용 효과성 평가 보고서를 심의했다. 중의협은 공공의료보험에서 지급되는 약가와 진료수가를 결정하는 자문기구다.
레켐비는 2023년 12월 13일 중의협 총회에서 경도인지장애(MCI) 및 경증 알츠하이머병 치료제로 공공의료보험 적용 대상에 등재됐다. 약가는 원가 계산 방식에 따라 200mg당 4만 5,777엔(한화 약 43만 원), 500mg당 11만 4,443엔(약 108만 원)으로 책정됐다. 레켐비는 2주마다 한 번(10mg/kg) 정맥주사로 투여된다.
레켐비의 최대 연간 시장 규모는 100억 엔(약 940억 원)으로 추산돼 고비용 약제에 해당하는 ‘H1’ 등급을 받아 비용 효과성 평가 대상 품목에 분류됐다.
중의협은 이번 심의에서 레켐비의 증분 비용 효과비(Incremental Cost Effectiveness Ratio, ICER) 분석 결과가 기준치보다 과도하게 높다는 이유로 약가 인하 대상에 해당한다고 평가했다.
ICER는 신약이 기존 치료보다 더 나은 효과를 얻기 위해 어느 정도 추가 비용이 발생하는지를 분석하는 지표다. 이때 개선 효과를 측정하는 척도로 ‘QALY(Quality-Adjusted Life Year)’ 지표를 사용했다.
QALY는 한 사람이 건강하게 1년을 추가로 사는 것과 동등한 효과를 기준으로 환자의 생존 기간과 삶의 질을 종합적으로 반영한 개념이다. 예를 들어, 신약 치료로 2년을 더 살아도 삶의 질이 절반으로 낮아진다면 1QALY로 계산된다.
중의협이 공개한 자료에 따르면, 레켐비의 ICER는 1QALY당 약 1,500~1,800만 엔 수준으로 나타났다. 이는 정부가 기준치로 설정한 500만 엔을 3배 이상 초과한 수치다.
일본 보건당국은 ICER가 500만 엔이 되도록 약가를 조정하고, 조정액의 25%만큼 인하하되 하한선을 기존 가격의 85% 이상으로 유지하는 정책 기준을 적용하고 있다. 이에 따라 레켐비의 약가는 최대 15%까지 내릴 수 있다.
이번 분석은 국립보건의료과학원 산하 보건의료경제평가연구센터(Center for Outcomes Research and Economic Evaluation for Health, C2H)가 작성한 보고서를 기반으로 했다.
C2H의 비용 효과성 평가전문위원회(Expert Committee of Cost-Effectiveness Evaluation, ECCEE)는 레켐비의 비교군으로 비약물적 중재와 도네페질 병용 요법을 설정했다.
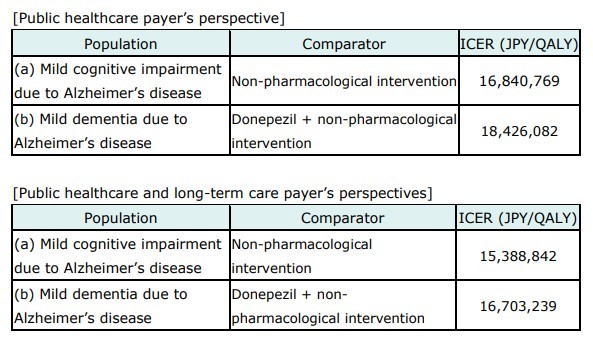
C2H가 ‘공공의료보험자 관점(Public healthcare payer’s perspective)‘에서 평가한 ICER는 경도인지장애 대상 1,684만 769엔, 경증 치매 대상 1,842만 6,082엔이다.
’공공의료 및 장기요양보험자 관점(Public healthcare and long-term care payer’s perspectives)‘에서는 경도인지장애 대상 1,538만 8,842엔, 경증 치매 대상 1,670만 3,239엔으로 산출됐다.
당국은 이러한 근거를 적용해 ICER 기준치에 상응하는 약가로, 공공의료보험자 관점에서 경도인지장애 대상 200mg의 경우 1만 3,567엔을 제시했다. 이는 현재 약가의 30% 정도다. 공공의료 및 장기요양보험자 관점에서의 경증 치매 대상 200mg 기준으로는 현재 약가의 25% 수준에 불과했다.
C2H는 이번 분석에서 임상 3상 시험 데이터를 근거로 레켐비의 치료 효과가 18개월 동안만 유효하다고 판단했다. 이는 18개월 시점에서 확인된 5.3개월의 지연 효과만을 반영한 것이다. 그 이후 장기 효과에 대해서는 정량적 근거가 부족하다는 이유로 인정하지 않았다.
또한 C2H의 자문그룹인 ATAG(Academic Technology Assessment Group)는 임상 3상에서 관찰된 CDR-SB 점수 변화에서 ‘임상적으로 의미가 있는 최소한의 차이(Minimal Clinically Important Difference, MCID)’에 미치지 못한 점을 지적했다.

이에 에자이는 레켐비의 가치를 과소평가했다며 이번 평가에 즉각 반박하는 성명을 발표했다.
에자이는 “이번 평가는 일본에서 처음으로 공적 간병을 포함한 ‘공공의료 및 장기요양보험자 관점’ 분석이 심의 대상에 올라 공적 분석에서도 공적 간병 비용이 고려됐다”고 반발했다.
특히 알츠하이머병은 수년에서 수십 년에 걸쳐 진행되는 질환으로, 비용 효과성 분석도 장기 시계열로 접근해야 한다고 강조했다.
또 임상 3상의 장기연장연구(Open Label Extension, OLE)에서 최대 36개월까지의 장기 유효성 데이터를 바탕으로 치료 효과가 지속되는 것을 확인했다고 주장했다.
에자이는 OLE의 CDR-SB 점수 변화에서 레켐비 투여군과 대조군 간의 격차가 시간이 지날수록 확대됐다는 점과 더불어 위험비(Hazard Ratio) 0.704의 수치를 장기 효과의 근거로 제시했다.
임상 2상 연구에서도 18개월 투여 완료 후 3개월 시점까지 위약군과 비교해 효과가 유지됐다고 설명했다.

간병인의 삶의 질(Quality of Life, QOL)을 비용 효과성 평가에 반영하는 문제에 대한 쟁점도 짚었다.
에자이는 임상 3상에서 수집된 간병인 QOL 데이터를 바탕으로 ‘가산적 접근법(Additive approach)’을 적용해 레켐비의 비용 효과성을 평가했다. 이 방식은 간병인이 환자와 함께 보내는 시간 자체를 긍정적인 가치로 평가하는 것이 특징이다. 환자가 현재 상태를 유지하거나 증상 악화 시점을 늦춰 간병인과 보내는 시간이 길어지는 효과에 의미를 둔 것이다. 이러한 접근법은 정부의 치매 기본법이 추구하는 ‘공생사회’ 철학과도 부합한다는 게 회사 측 주장이다.
반면에 당국이 채택한 ‘감산적 접근법(Decrement approach)’은 환자의 치매 진행 단계에 따라 간병인의 간병 부담이 얼마나 늘어나는지를 측정한다. 경도인지장애부터 중증 치매에 이르기까지 이전 단계와 비교해 간병 부담의 증가분만을 간병인 QOL에 반영하는 방식이다. 특히 간병 부담이 가장 큰 중증 치매 단계에서는 간병인 QOL이 ‘0’으로 설정되는 점을 지적했다.
에자이는 감산적 접근법을 적용하면 간병인 QOL의 개선 효과가 경도인지장애 단계에만 일부 반영되고, 이후 진행 단계마다 레켐비 투여군과 비교군 간 지속 기간을 동일하게 간주한다고 비판했다. 이러한 탓에 레켐비의 간병인 QOL 개선 효과가 비용 효과성 평가에 거의 반영되지 않는다는 분석이다.
이와 함께 ICER 기준치에 대해서도 당국과의 이견을 보였다.
에자이는 당국 기준인 1QALY당 500만 엔이 지나치게 보수적이라는 입장이다. 희귀질환이나 소아질환, 항암제 등에는 이미 750만 엔 기준이 적용되고 있으며, 알츠하이머병 역시 질병의 중증도와 사회적 부담을 고려할 때 같은 범주에 포함될 수 있다는 설명이다. 에자이는 자체 모델을 통해 산출한 ICER로 환자 상태와 당국 관점에 따라 600~800만 엔 수준을 제시했다.
또한 미국에서는 레켐비의 ICER 기준치를 5만 달러에서 최대 20만 달러(약 2,900만 엔)까지 제시하고 있으며, 세계보건기구(WHO)의 권고 사항도 국내총생산(GDP) 대비 1~3배를 기준으로 삼아 더 유연한 적용이 필요하다고 요구했다.
한편, 최근 영국 국립보건임상평가연구원(National Institute for Health and Care Excellence, NICE)와 스코틀랜드 의약품 컨소시엄(Scottish Medicines Consortium, SMC)에서도 레켐비의 비용 효과성을 문제 삼아 건강보험 등재에 반대하는 의견을 잇달아 발표했다.

