임상 불확실성과 높은 비용 부담 걸림돌...두 번째 회의에서도 논란 지속
투여 및 모니터링 관련 비용 과소평가...‘관리형 접근’ 방식도 불가
영국 국립보건임상평가연구원(NICE)가 초기 알츠하이머병 치료제인 레켐비(Leqembi, 성분명 레카네맙 Lecanemab)의 비용 효과성 평가에서 부정적 견해를 유지했다. NICE는 최근 진행된 두 번째 평가위원회 회의에서도 레켐비의 비용 대비 효과가 충분하지 않다고 판단했다.
NICE는 오는 5월 14일 세 번째 평가위원회 회의를 개최할 계획이다.

NICE는 지난 6일(현지 시간) 영국 국가보건서비스(NHS)의 레켐비 도입 여부를 재평가한 결과, 비용 효율성 비율(ICER)이 여전히 기준을 충족하지 못한다는 초안 지침을 공개했다.
레켐비는 지난해 8월 영국 의약품 및 의료제품 규제청(MHRA)으로부터 APOE4 유전자가 전혀 없거나 1개만 보유한 환자에 한해 조건부 승인을 받았다.
NICE는 첫 번째 초안 지침에서 “비용 효과성 추정치가 NHS 자원 사용에 대해 일반적으로 인정하는 범위를 넘어선다”는 이유로 레켐비를 권고하지 않았다.
또한 ▲전이 확률의 표면 타당성(Face validity of transition probabilities) ▲치료 중단이 결과에 미치는 영향 ▲모델에 사용된 유틸리티값 ▲투여·검사·개인간병 비용 등에 대한 불확실성이 높다고 평가했다.
이러한 이유로 NICE는 최종 지침을 확정하기 전에 추가적인 협의가 필요하다고 봤다.
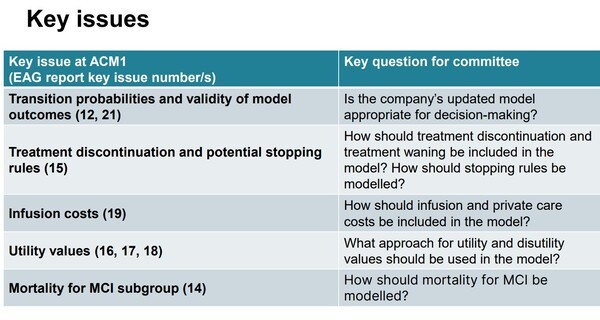
이번에 공개된 두 번째 초안 지침에 따르면, NICE의 독립평가그룹(EAG)은 레켐비의 비용 효과성 추정치가 NICE의 수용 가능 범위를 초과해 NHS의 자원을 효율적으로 활용하는 방안으로 보기 어렵다는 의견을 재확인했다.
특히 EAG는 투여 및 모니터링 관련 비용에 대해 과소평가가 됐다고 문제를 제기했다. 레켐비는 병원에서 2주마다 정맥주사로 투여하는 방식이며, 심각한 부작용 가능성으로 지속적인 모니터링도 필요해 치료비 증가 요인으로 작용한다.
이와 함께 치료 중단 환자들이 얼마나 오랫동안 치료 효과를 유지할 수 있는지에 대해 명확한 데이터가 부족하다고 지적했다.
NICE는 레켐비의 핵심 기전인 아밀로이드 베타 플라크 제거가 실제로 임상적 개선과 직접적으로 연결되는지에 대한 불확실성도 제기했다. 현재까지의 연구 결과만으로는 레켐비가 알츠하이머병 환자의 인지 기능 저하를 유의하게 늦춘다는 확신을 갖기 어렵다는 것이다.
아울러 치료 과정에서 필수적인 부작용 모니터링과 이에 따른 의료 자원 소모 문제도 여전히 해결되지 않은 상태다. NHS 내에서 안정적으로 치료를 제공하려면 상당한 인프라 투자가 필요하지만, 현재로서는 그에 대한 명확한 계획이 마련되지 않은 상황이다.
NICE는 이러한 요인들이 비용 효과성 평가에 직접적인 영향을 미치며, 이 문제들에 대한 추가적인 데이터와 논의가 필요하다고 밝혔다.

한편, 레켐비를 도입하기 위한 관리형 접근(Managed Access) 방식도 추천되지 않았다.
관리형 접근은 NHS에서 새로운 치료제를 도입할 때 일정 기간 추가 데이터를 수집하면서 제한적으로 접근을 허용하는 방식이다. 이는 신약을 완전 승인을 하기에는 불확실성이 크지만, 환자들이 치료받을 기회를 완전히 차단하는 것도 부담이 될 경우, 조건부 사용을 허용하면서 데이터를 더 모으는 제도다.
이에 대해 NICE는 관리형 접근 방식으로도 비용 효율성 문제가 해결되지 않을 가능성이 크다고 판단했다. 추가 임상 데이터가 나오더라도 레켐비의 효과가 비용 대비 충분한 가치를 제공할 것이라는 보장이 없다는 것이다. 또 치료받는 동안 환자 모니터링, 부작용 관리 등의 부담이 너무 크다고 결론지었다.
이번 초안에 따르면 회사 측이 제시한 레켐비의 가격은 200mg의 경우 275파운드(한화 약 51만 원), 500mg은 545파운드(약 102만 원)다.
NICE는 레켐비와 같은 계열의 항아밀로이드 치료제인 키선라(Kisula 성분명 도나네맙 Donanemab)도 함께 평가 중이다.

- 호주, 재심사에도 ‘레켐비’ 등록 불허...“APOE4 없어야 투약 가능”
- 스코틀랜드 NHS 자문위 “레켐비, 미미한 임상적 이점에 불확실성 남아”
- 유럽의약품청 자문위, 의견 바꿔 ‘레켐비’ 승인 권고...“ApoE ε4 2개 보유자 제외”
- 英 허가받은 ‘키선라’, 건보 적용은 ‘실패’...“효과 대비 비용 5~6배 높아”
- 英 연구진 “레켐비·키선라, 효과 ‘낮고’ 부작용 ‘빈번’”
- 일라이 릴리 ‘키선라’, 유럽 약물사용자문위원회서 시판 허가 “거부”
- 블룸버그 “美, 최근 2년간 레켐비 부작용으로 최소 7명 사망”
- 일라이 릴리 ‘키선라’, 승인 거부한 EMA에 재심사 요청
- [기자의 눈] 레카네맙, 치매 치료 혁신인가? 신중한 접근 필요한 이유
- [기자의 눈] 대한치매학회, ‘치매 공포’ 앞세운 신약 중심 정책 촉구 논란
- 英 NICE, 레켐비·키선라에 급여 적용 ‘퇴짜’...“효과 작고 재정 감당 안 돼”
- 에자이, 英 레켐비 급여 등재 불가에 ‘정면 반박’...“공짜로 줘도 승인 안 돼”
- 레켐비, NHS 스코틀랜드 자문위서 재차 불허...“불확실성 여전”
- 日 정부, ‘레켐비’ 약가 인하 검토...“효과 대비 비용 과도”
