HSV-1 감염 후 cGAS-STING 경로에서 타우 인산화...면역 반응
만성적 타우 과인산화, 독성 일으켜 알츠하이머병 악화 원인 ‘두 얼굴’
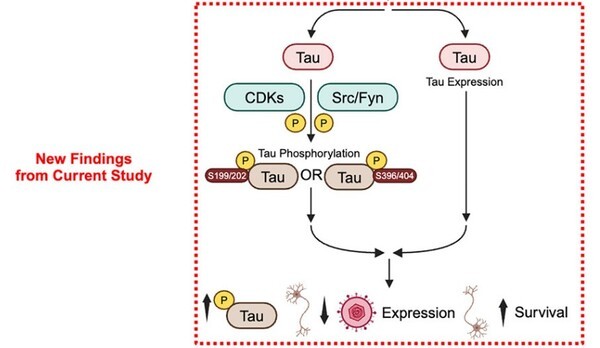
알츠하이머병을 일으키는 핵심 병리로 추정되는 타우 인산화가 오히려 선천성 면역 반응으로써 신경 세포를 보호하는 역할을 한다는 연구 결과가 나왔다.
미국 피츠버그대(University of Pittsburgh) 연구팀은 ‘1형 단순 헤르페스 바이러스(HSV-1)’ 감염이 알츠하이머병 병리인 ‘타우 인산화(p-Tau)’와 깊은 연관성을 보인다는 내용을 발표했다.
연구팀은 알츠하이머병 환자의 뇌 샘플에서 HSV-1의 초기 감염 단계에서 발현되는 ICP27(Immediate-Early Infection Cell Protein 27) 단백질을 관찰했다. ICP27는 바이러스의 복제에 필수적으로, 억제되거나 삭제되면 바이러스 복제가 불가능해진다.
연구에서는 알츠하이머병이 진행될수록 ICP27의 발현 영역이 현저하게 증가하는 동시에 인산화된 타우의 엉킴(tangles)이 공존하는 모습을 보였다. 단, 다른 알츠하이머병 병리인 아밀로이드 베타(Aβ)와는 공존하지 않았다.
특히 HSV-1 감염은 타우 인산화를 촉진하는 것으로 나타났다. 타우 인산화는 ICP27의 발현을 억제하면서 감염 후 신경 세포 사멸을 64%에서 7%까지 감소시켰다. 이는 타우 인산화가 알츠하이머병에서 선천성 면역 반응 역할을 하면서 뇌를 보호하는 메커니즘을 작동시킨다는 것을 시사한다.
하지만 만성적인 타우의 과인산화는 독성으로 이어져 알츠하이머병을 악화하는 원인이 될 수 있다고 분석했다.
또한 연구팀은 타우 인산화를 조절하는 핵심 면역 반응 경로인 ‘cGAS-STING-TBK1’를 밝혀냈다.
이 밖에도 미세아교세포(microglia)에서 ICP27과 타우 인산화가 공존하며 발현하는 사실을 확인했다. 미세아교세포는 ICP27이 가득한 신경 세포를 삼키거나 직접 감염을 통해 발현할 수 있다.
다만 HSV-1와 타우 간 복잡한 상호 작용 메커니즘을 밝혀내기 위해서는 추가 연구가 필요하다고 지적했다.
이번 연구 결과는 지난 2일 국제 학술지 ‘셀 리포츠(Cell Reports)’ 온라인판에 실렸다.
Primary Source
Hyde et al., Anti-herpetic tau preserves neurons via the cGAS-STING-TBK1 pathway in Alzheimer’s disease, Cell Reports (2024), https://doi.org/10.1016/j.celrep.2024.115109

- 대상포진 백신이 치매 위험을 감소시킨다
- 대상포진 바이러스 감염 연쇄반응, 알츠하이머병 촉발 사실일까?
- "코로나19 감염 환자, 신경계증후군 규명 필요"
- [곽용태 칼럼] 카산드라 콤플렉스 혹은 카산드라 후회
- 英·美 연구진 “뇌진탕이 잠복한 HSV-1 바이러스 되살려 치매 일으킨다”
- 美 스피어바이오 “FDA, 자사 p-Tau 혈액 검사에 혁신의료기기 지정”
- “알츠하이머병서 뇌 타우 분포 비대칭, 아밀로이드 베타가 방향 결정”
- ‘입술 헤르페스’ HSV-1, 치매 위험 높일 수도…30년 연구가 밝혀낸 연관성
- 대상포진·헤르페스, 치매 위험 크게 높이지 않지만…치료하면 줄어든다
