전체 매출은 2분기比 33% 증가...누적 매출 2,820억 규모
美 치료 환자 1만 3,500명, 日 6,800명...‘유지 투여 요법’ 기대
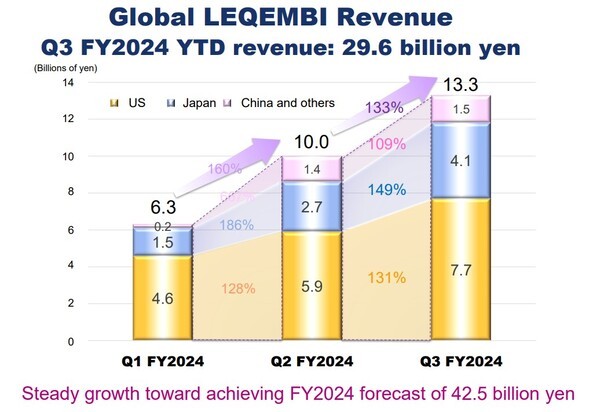
에자이(Eisai)는 초기 알츠하이머병 치료제 ‘레켐비(Leqembi, 성분명 레카네맙 Lecanemab)’가 글로벌 시장에서 지난 3분기(9~12월, 3월 결산법인) 총 133억 엔(한화 약 1,270억)의 매출을 거뒀다고 7일 밝혔다.
이는 2분기(100억 엔, 약 950억 원)보다 약 33% 증가한 수치다.
지역별 매출 비중을 살펴보면, 미국이 77억 엔(약 730억 원)으로 전체의 58%를 차지했다. 뒤를 이어 일본 41억 엔(약 390억 원), 중국 13억 엔(약 120억 원) 순이었다. 지난 분기와 비교하면, 주력 시장인 미국에서 28.3% 성장한 반면, 일본 시장 매출은 80% 증가한 것으로 나타났다. 중국에서는 매출 변화가 없었다.
3분기(4~12월)까지 글로벌 누적 매출액은 296억 엔(약 2,820억 원) 규모로, 연간 목표치인 425억 엔(약 4,050억 원)의 70%를 달성했다. 에자이는 연간 글로벌 매출 전망치를 충족할 것으로 예상했다.
지역별 누적 매출은 미국 181억 엔(1,720억 원), 일본 83억 엔(약 790억 원), 중국 28억 엔(약 270억 원)을 각각 기록했다.
앞서 에자이는 2분기 실적 발표를 통해 연간 매출 전망치를 565억 엔(약 5,380억 원)에서 425억 엔으로 약 25% 하향했다. 기존의 미국 매출 전망치를 435억 엔(약 4,140억 원)에서 265억 엔(약 2,530억 원)으로 내린 데 따른 것이다. 다만, 일본 매출 전망은 기존 100억 엔(약 950억 원)에서 120억 엔(약 1,140억 원)으로 20% 상향했다.
향후 레켐비의 실적 개선은 미국 시장 확대에 달린 것으로 보인다. 나이토 하루오 에자이 CEO는 2분기 실적 설명회에서 미국 시장의 전망치를 크게 하향 조정한 이유에 대해 주입 센터 부족에 따른 병목 현상 탓이라고 해명했다. 애초 레켐비 투여 대상 환자 수를 1만 명으로 예상했지만 4,000명만 치료를 시작해 판매 실적 반영이 4개월 정도 지연됐다는 설명이다.
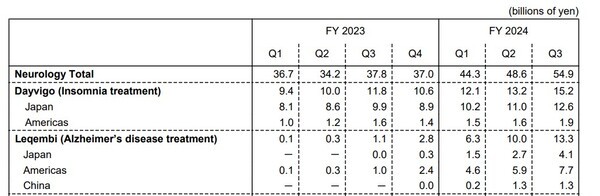
에자이는 이번 실적 자료를 통해 미국 시장의 우려에 대한 낙관적인 전망을 내놨다. 레켐비를 구매하는 의료 기관이 약 1,200곳으로 2분기보다 112% 증가했고, 처방 의사도 3,000명 이상으로 꾸준히 늘고 있다는 것이다. 현재 레켐비로 치료받는 환자 수 약 1만 3,500명이라고 밝혔다.
아밀로이드 베타(Aβ) PET 검사 실시 건수가 늘면서 3분기에는 전 분기보다 145% 증가한 것도 레켐비 처방에 우호적인 환경 변화로 분석했다.
미국의 공공의료보험 관리 기관인 메디케어 및 메디케이드 서비스 센터(CMS)가 2023년 10월 검사 횟수에 대한 상한을 푼 이후, 지난해 11월 27일 OPPS(Medicare Hospital Outpatient Prospective Payment System) 규칙을 개정하면서 올해부터 PET 검사에 대한 비용 한도를 없애는 조항이 발효됐다.
이에 따라 PET 검사 사용이 증가할 것으로 예상하면서 아밀로이드 베타 양성률도 높아질 것으로 기대하는 모습이다.
아울러 올해부터 PCP(Primary Care Physician)를 대상으로 한 소통을 시작해 시장 확대에 적극적으로 나선다는 계획이다. 에자이는 내년부터 미국에서 혈액 기반 바이오마커(Blood-based Biomarker, BBM)가 아밀로이드 베타 진단에 사용되면 PCP의 참여가 가능할 것으로 전망했다.
현재 약 6,800명의 환자가 치료 중인 일본 시장에 대해서도 자신감을 내비쳤다.
에자이는 처방 의사가 1,200명 이상으로 전 분기보다 125% 증가했고, 레켐비를 투여하는 의료기관도 660곳으로 120% 성장했다고 설명했다. 이외에도 환자 접근성이 좋은 지역사회 중심의 치매 전문 병원 1,400곳에서 6개월 이상 투여받은 환자를 치료하는 데 동의했다고 전했다.
또 조기 검진을 유도하기 위해 지난해부터 경도인지장애(MCI)에 대한 인식을 높이는 TV 광고도 시작했다.

특히 에자이는 새로운 투여 요법에 기대를 걸고 있다. 미국 식품의약품청(FDA)은 지난달 24일 18개월 초기 치료를 마친 후 월 1회(4주) 유지 투여하는 요법에 대한 승인을 받았다.
에자이가 게임체인저로 지목한 피하주사제(SC-AI)는 주 1회 유지 투여 요법이 지난해 11월 BLA(Biologics License Application) 승인을 받아 올해 8월 31일 FDA의 허가 심사 완료를 앞두고 있다.
한편, 에자이는 레켐비의 적응증 확대를 위해 전임상(무증상) 알츠하이머병 환자를 대상으로 한 임상 3상 ‘AHEAD 3-45’를 일본, 미국, 유럽 등에서 진행하고 있다.

- ‘레켐비’ 유럽 승인 지연...EC, 자문위에 안전성 재평가 요청
- 美 FDA, ‘레켐비’ 정맥주사 月 1회 유지 투여 승인
- 美 FDA, ‘레켐비’ 주 1회 유지 투여용 피하주사 BLA 승인
- 에자이 CEO “레켐비, ‘피하 자동주사기’·‘혈액 바이오마커’가 게임체인저”
- 스코틀랜드 NHS 자문위 “레켐비, 미미한 임상적 이점에 불확실성 남아”
- 바이오아크틱, ‘레켐비’ 첫 매출 마일스톤 달성..."로열티 1,000만 유로"
- 美 연구팀 “간테네루맙, 무증상 알츠하이머병 예방에 효과” 주장
- 에자이, ‘레켐비’ 2027년 판매 전망 대폭 하향...“美 시장 성장 더뎌”
- 블룸버그 “美, 최근 2년간 레켐비 부작용으로 최소 7명 사망”
- ‘레켐비’ 2분기 매출 2,270억...“中, 美 관세 대응 500억 규모 재고 쌓아”
- 에자이·바이오젠, 자가주사제 '레켐비 아이클릭' 적용 확대 박차
