도나네맙 승인 후 O-GlcNAcase 억제제인 LY3372689, 2상시험 실패 밝혀

8일 외신에 따르면, 미국 FDA가 7월 2일 알츠하이머병 치료제 도나네맙(상품명 키선라)을 승인함으로 파티 분위기인 일라이 릴리가 후속 약인 초기 타우 표적 치료제 개발에는 실패한 것으로 전했다.
릴리 최고과학책임자 겸 릴리연구소 사장 다니엘 스코브론스키(Daniel Skovronsky) 박사는 최근 임상 2상 시험의 1차 평가변수에서 O-GlcNAcase 억제제인 LY3372689가 실패했다고 밝혔다. OGA 효소를 표적으로 하는 이 치료법은 두 용량 모두에서 알츠하이머 중증도 평가 척도의 기준선에서 종료점까지의 시간을 변화시키지 못했다.
스코브론스키 박사는 지난 8일 일라이 릴리 2분기 실적 발표에서 “부정적인 결과로 실망스럽지만, 알츠하이머병 치료에서 높은 확신을 가진 타우 표적 치료제를 계속 연구할 것”이라고 말했다. 현재 릴리의 임상 단계 파이프라인에는 타우를 타깃으로 하는 다른 후보 물질은 없다.
LY3372689는 중추 신경계에서 과인산화된 불용성 타우 응집체의 축적을 늦추도록 설계됐다. 타우 응집체는 서로 뭉쳐 신경원섬유 ‘엉킴’을 형성한다. 신경원섬유 엉킴은 릴리의 최근 승인된 키선라(Kisunla, 도나네맙)와 에자이와 바이오젠의 레켐비(Leqembi, 레카네맙)가 타깃으로 한 베타 아밀로이드 플라크와 함께 알츠하이머병의 특징 중 하나다.
LY3372689는 릴리의 차세대 알츠하이머 치료제 개발의 핵심이었다. 릴리는 7월에 도나네맙이 키선라로 판매되는 승인을 받은 후, 타우 표적 치료제가 알츠하이머병과 싸우는 다음 전선이 되기를 바랐다.
타우 엉킴은 파킨슨병과 근위축성 측색 경화증(ALS), 운동 신경 질환(MND)으로도 알려진 루게릭병 등 다른 신경 퇴행성 질환의 특징이기도 하다.
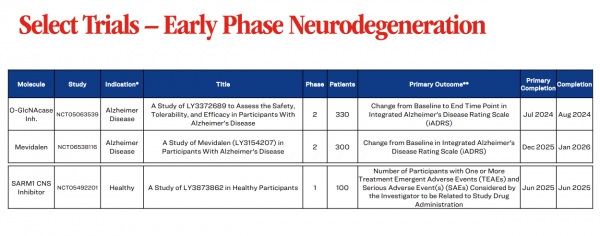
OGA 억제제를 연구하는 다른 회사로는 지난달 노보 홀딩스(Novo Holdings)가 주도하는 시리즈 C에서 1억 달러를 모금하여 후보물질 ASN51의 중간 단계 임상시험에 사용할 예정인 어세뉴런(Asceneuron)이 있다. 한편, 바이오젠은 올해 초 건강한 지원자를 대상으로 한 BIIB113 후보물질의 1상 데이터를 보고했으며, MSD/Alectos는 MK-8719라는 억제제를 전임상 시험 중이다.
타우는 아밀로이드 계열과 마찬가지로 임상시험 결과가 엇갈리지만, 알츠하이머병 치료제 개발자들 사이에서 여전히 인기 있는 표적이다. 릴리는 2021년에 항체 기반 타우 억제제인 자고테네맙(Zagotenemab)을 포기했고, 올해 초에는 로슈가 AC Immune과 제휴한 후보물질 세모리네맙(Semorinemab)에 대한 권리를 반환했다. 두 결정 모두 실망스러운 2상 결과가 나온 후에 내렸다.
한편 더 넓은 타우 표적 파이프라인으로 에자이의 항체 기반 E-2814와 Annovis Bio(분타네탭), BioVie(베지스테림), TauRx(HMTM)의 소분자 약물을 포함한 소수의 3상 후보물질이 있다. 이 약물들은 7월 영국에 경도인지장애와 경증 및 중등도 알츠하이머병 치료를 위한 승인 신청에 들어가 있다.

- ‘위고비’로 대박난 노보 홀딩스, 알츠하이머병 치료제 개발사에 1억佛 투자 주도
- 국내 연구진 “만성 수면부족이 치매 유발...글루코사민 치료 효과 有”
- 英 연구진 “레켐비·키선라, 효과 ‘낮고’ 부작용 ‘빈번’”
- 랜싯 치매 위원회가 본 ‘항아밀로이드 항체 치료제 논란’
- 항아밀로이드 치료제 개발서 발 뺀 애브비...알츠하이머병 신약 후보물질 포기
- 알츠하이머병의 항아밀로이드 치료, 90% 예방 가능한 백신 아니다
- 美 NIH, 2026년 치매 R&D 예산 ‘5조 5천억’...신규 연구에 6천억 추가
- ‘레켐비’에 제동 건 유럽의약품청 자문위...약심위조차 열지 않은 한국 식약처
- 알츠하이머병 치료제 도나네맙, FDA 승인...릴리 "1년 약제비 4451만원"
- [기자의 눈] ‘강남 치매 명의’의 퇴출된 치매 치료제 투약비 논란
- 일라이 릴리, 아일랜드에 18억 달러 추가 투자...‘키선라’ 등 생산 확대
- 日 후생노동성, 초기 알츠하이머병 치료제 '도나네맙' 승인
- [치매 정복 나선 K-바이오텍] ④ 아델 윤승용 대표
- 연세대 김영수 교수 연구팀, 치매 유발 타우 단백질의 응집 기전 규명
- [칼럼] 레켐비의 명암
- 국가임상시험지원재단, 아시아 최대 임상시험 콘퍼런스 ‘제10회 2024 KIC’ 개최
- 로슈, 항타우 항체 치료제 ‘베프라네맙’ 개발 포기...UCB에 권리 반환
- 英 언론 “NHS, 내년 타우 표적 ‘먹는 치매약’ 승인 앞둬”
