자문위 권고 한 달 채 안 돼...진행 최대 35% 늦추고 Aβ 84%까지 제거
레켐비보다 월 1회 투여, 치료 중단 장점...안전성·유효성 논란 여전

미국 식품의약품청(FDA)은 2일(현지시간) 글로벌 제약사 일라이 릴리(Eli Lilly and Company)가 개발한 초기 알츠하이머병 치료제 도나네맙(Donanemab, 제품명 키선라 Kisunla)을 승인했다고 밝혔다.
지난달 10일 FDA 말초·중추신경계 약물 자문위원회가 도나네맙의 승인을 권고한 지 한 달도 채 안 돼서다.
당시 자문위는 도나네맙이 초기 알츠하이머병 환자의 질병 진행 속도를 늦추는 데 효과가 있고, 약물의 위험성보다 이익이 더 크다는 판단하에 만장일치로 의견을 모았다.
테레사 부라치오(Teresa Buracchio) FDA 약물평가연구센터 국장은 이번 승인에 대해 “키선라가 알츠하이머병 경도인지장애(MCI) 및 경증 치매 단계 환자의 인지 기능 저하 속도를 늦춘다는 사실을 임상 데이터로 설득력 있게 보여줬다”면서 “오늘 승인은 더 안전하고 효과적인 알츠하이머 치료 약물이 사용될 수 있도록 지원하겠다는 FDA 약속의 증거다”라고 말했다.
릴리도 이날 보도자료를 통해 키선라(350 mg/20 mL)의 승인 소식을 알렸다.
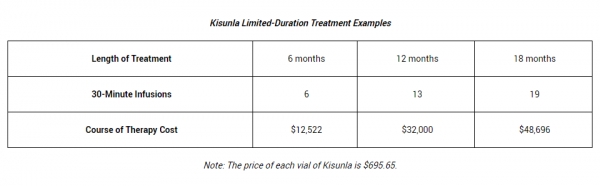
릴리에 따르면, 키선라는 알츠하이머병을 유발하는 아밀로이드 베타(Aβ) 플라크(Plaques, 덩어리) 제거로 치료를 중단하는 근거를 처음으로 갖춘 Aβ 단백질 표적 단일 클론 항체 치료제다. 월 1회 최소 30분 정맥 투여하는 방식으로 기존 치료 비용과 주사 횟수를 줄일 수 있다.
임상 3상(TRAILBLAZER-ALZ2) 연구에서는 알츠하이머병 초기 단계 환자가 키선라를 투여했을 때 효과가 가장 좋은 것으로 나타났다.
타우 단백질 수치가 낮거나 중간 정도인 환자군에서는 통합 알츠하이머병 평가 척도(integrated Alzheimer's Disease Rating Scale, iADRS)에서 인지 기능 저하 속도를 위약 대비 35% 늦췄다. 전체 투여 환자군에서도 22% 감소한 것으로 나타났다. Aβ 플라크도 연구 시작 시점 기준으로 6개월 평균 61%, 12개월 80%, 18개월 84%까지 제거됐다.
또 양전자방출단층촬영(PET) 스캔으로 Aβ 수치를 평가한 결과, 전체 환자군에서 6개월 17%, 12개월 47%, 18개월 69%가 치료를 마쳤다.
키선라는 앞서 출시해 사실상 정맥 투여 방식 알츠하이머병 항체 치료제 시장을 독점해 왔던 에자이(Eisai)와 바이오젠(Biogen)의 레켐비(Leqembi, 성분명 Lecanemab)와 경쟁할 전망이다. 시장에서는 효능과 투약 편의 면에서 키선라에 더 높은 점수를 주고 있다. 현재 레켐비는 2주에 한 번씩 투여해야 한다.
경제성 측면에서는 키선라가 레켐비보다 환자 부담이 더 클 것으로 보인다. 릴리가 공개한 키선라의 바이알당 약값은 695.65달러다. 12개월 기준으로 치료 과정에 드는 약제비용(Course of Therapy Cost)은 3만 2,000달러(한화 약 4,451만 원)로 레켐비(2만 6,500달러, 한화 약 3,685만 원)보다 21% 정도 더 높다. 하지만 레켐비는 Aβ가 제거된 이후에도 유지 투여하는 방식으로 단순 비교가 어렵다는 시각도 있다.
다만 안전성과 유효성 면에서는 여전히 논란이 남아있다. 키선라는 레켐비와 마찬가지로 Aβ 단백질 표적 단일 클론 항체 치료제의 특성상 혈관 내 부종(Edema)이나 출혈(Hemorrhage)을 일으키는 ‘아리아(Amyloid-Related Imaging Abnormalities, ARIA)’ 부작용을 유발한다.
알츠하이머병 위험 유전자인 APOE ε4를 2개 보유한 동형접합형 환자에게서는 아리아 위험성이 훨씬 더 높다.
효능 면에서도 한계를 보여준다. Aβ를 효과적으로 제거하더라도 ‘임상적 의미를 가지는 최소한의 차이(Minimal Clinically Important Difference, MCID)’ 개념에서는 키선라 역시 기준치에 달하지 못한다. 통계적 의미를 넘어 임상적으로 체감할 수 있는 효과를 얻지 못한다는 것이다. 일각에서는 항아밀로이드 치료제의 근본적인 문제로 보고 있다.
한편, 국내에서는 한국릴리가 대형 종합병원과 대학병원 등 15곳에서 도나네맙의 임상 3상 진행을 위해 참가자를 모집 중이다. 레켐비는 지난 5월 24일 식품의약품안전처로부터 품목 허가를 받아 미국, 일본, 중국에 이어 세계 네 번째로 국내 시판할 수 있는 길이 열렸다.

- [치매 정복 나선 K-바이오텍] ① 아임뉴런 김한주 대표 (下)
- [단독] 치매 치료제 레켐비, 중앙약심위 안 거쳐...식약처 “필수 절차 아니다”
- [기자의 눈] 알츠하이머병 치료에 옵션 하나 추가한 무리수, 도나네맙 승인되나
- 안전성 논란에도...美 FDA 자문위, 알츠하이머병 치료제 ‘도나네맙’ 승인 권고
- 10일 열리는 도나네맙의 FDA 자문위원회의, 허가될까?
- [칼럼] 치매의 묘약, 알츠하이머가 부르는 아리아
- [칼럼] 알츠하이머 신약은 메시아가 될 수 있을까?
- [칼럼] 도나네맙과 임상적 의미를 가지는 최소 효과
- 식약처, '레켐비' 품목허가 승인...알츠하이머병 치매 치료제 '국내 첫 상륙'
- 국내 승인 초읽기 레카네맙, 치매 치료 패러다임 변화 가져올까?
- 알츠하이머병 치료제 ‘레켐비’, 美 FDA에 피하주사제 허가 신청
- 美 FDA, 내달 10일 알츠하이머병 치료제 ‘도나네맙’ 허가 논의
- 2024년 알츠하이머병 치료제 개발 “127개 약물, 임상 3상 48건”
- ‘알츠하이머병 치료제’ 드디어 국내 첫발 떼나...글로벌 제약사에 쏠린 ‘눈’
- 레켐비, 홍콩서 세계 다섯 번째 보건당국 승인
- 항아밀로이드 치료제 개발서 발 뺀 애브비...알츠하이머병 신약 후보물질 포기
- [DN 산업 브리핑] ETRI·일라이릴리·뷰노
- 랜싯 치매 위원회가 본 ‘항아밀로이드 항체 치료제 논란’
- 英 연구진 “레켐비·키선라, 효과 ‘낮고’ 부작용 ‘빈번’”
- 일라이 릴리, 도나네맙 후속 '타우 표적 알츠하이머 치료제' 실패
- 日 후생노동성, 초기 알츠하이머병 치료제 '도나네맙' 승인
- 英 의학저널 “‘도나네맙 승인 권고’ FDA 자문위원, 개발사 릴리와 금전적 관계” 폭로
- 국가임상시험지원재단, 아시아 최대 임상시험 콘퍼런스 ‘제10회 2024 KIC’ 개최
- 英 허가받은 ‘키선라’, 건보 적용은 ‘실패’...“효과 대비 비용 5~6배 높아”
- FDA 인증 오해 말아야...‘허가’, ‘승인’, ‘등록’의 차이점
- 일라이 릴리 "中, 초기 알츠하이머병 치료제 ‘키선라’ 승인"
- ‘레켐비’ 원개발사 바이오아크틱, 美 BMS와 13.5억佛 규모 항체 치료제 계약 체결
